JCO | 新ADC选择:T-Duo显著延长HER2阳性乳腺癌患者的PFS(Ⅲ期TULIP试验)
2024-10-26 daikun MedSci原创 发表于上海
该研究旨在评估T-Duo在经过至少2线HER2靶向治疗或T-DM1治疗后进展的局部晚期/转移性HER2阳性乳腺癌患者中的疗效和安全性,研究结果显示T-Duo能够显著延长患者的PFS。
乳腺癌是全球女性最常见的恶性肿瘤之一,严重威胁着女性的健康和生命,近年来,随着分子生物学研究的深入,乳腺癌的治疗已经进入精准医疗时代,根据不同的分子分型进行个体化治疗,取得了显著的疗效,HER2阳性乳腺癌是乳腺癌的一种亚型,HER2的过度表达与乳腺癌的侵袭性、转移能力和不良预后密切相关,幸运的是,针对HER2的靶向治疗药物已经问世,为HER2阳性乳腺癌患者带来了希望,曲妥珠单抗作为第一个上市的HER2靶向药物,改变了HER2阳性乳腺癌的治疗格局,显著延长了患者的生存期,随后,帕妥珠单抗、拉帕替尼、奈拉替尼等HER2靶向药物也相继问世,进一步丰富了HER2阳性乳腺癌的治疗选择,然而,HER2阳性乳腺癌患者在使用HER2靶向治疗药物后,仍然面临着肿瘤进展的风险,随着治疗的深入,患者对现有药物的耐药性逐渐增强,需要新的治疗方案来克服耐药性,延长患者的生存期,抗体药物偶联物(ADC)是一种新型的靶向治疗药物,将靶向抗体和细胞毒性药物偶联在一起,可以提高药物的靶向性和杀伤力,同时减少对正常组织的毒性。恩美曲妥珠单抗(T-DM1)和德曲妥珠单抗(T-DXd)是两种针对HER2的ADC药物,已经在临床应用中取得了显著的疗效。曲妥珠单抗-多卡马嗪(T-Duo) 是一种新型的HER2靶向ADC药物,由曲妥珠单抗、可裂解连接子和细胞毒性药物双硫氮杂蒽组成。临床前研究显示,T-Duo在HER2阳性乳腺癌细胞中表现出强大的杀伤作用,并且具有良好的安全性。TULIP试验 是一项随机、开放标签的III期临床试验,旨在评估T-Duo在经过至少2线HER2靶向治疗或T-DM1治疗后进展的局部晚期/转移性HER2阳性乳腺癌患者中的疗效和安全性。

方法
该研究是一项开放标签、随机、III期临床试验,纳入患者年龄 ≥ 18 岁,ECOG体能状态为 0-2,患者为经过至少2线HER2靶向治疗或T-DM1治疗后进展的局部晚期/转移性HER2阳性乳腺癌,患者2:1随机分配到T-Duo组或医生选择(PC)组,T-Duo组: 患者接受T-Duo 1.2 mg/kg,静脉输注,每3周一次,PC组: 医生选择的化疗方案,包括拉帕替尼/卡培他滨、曲妥珠单抗/卡培他滨、曲妥珠单抗/长春瑞滨或曲妥珠单抗/艾瑞布林,直至疾病进展、不可接受的毒性或撤回知情同意,主要终点为中心影像学评估的无进展生存期(PFS),次要终点为总生存期(OS)、客观缓解率(ORR)、研究者评估的PFS、生活质量、安全性。
研究结果
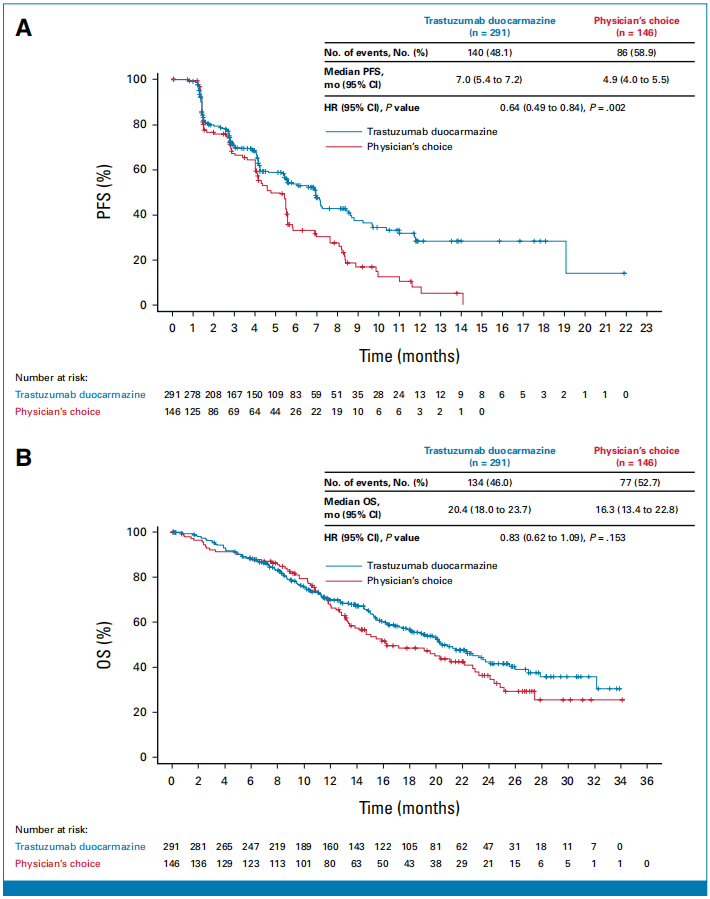
主要终点:T-Duo组的中位PFS为7.0个月,PC组为4.9个月,HR为0.64 (95% CI, 0.49 to 0.84; P = .002),表明T-Duo显著延长了患者的PFS。
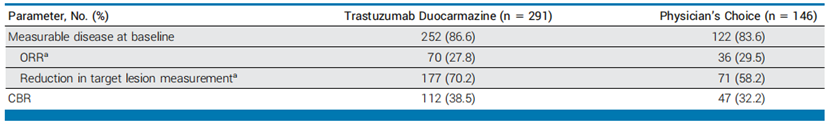
次要终点:T-Duo组的ORR为27.8%,PC组为29.5%。T-Duo组的CBR为38.5%,PC组为32.2%。T-Duo组的DOR为15.1个月,PC组为4.6个月。T-Duo组有70.2%的患者靶病灶缩小,PC组为58.2%。T-Duo组的OS为20.4个月,PC组为16.3个月,HR为0.83 (95% CI, 0.62 to 1.09; P = .153),差异无统计学意义。
安全性分析
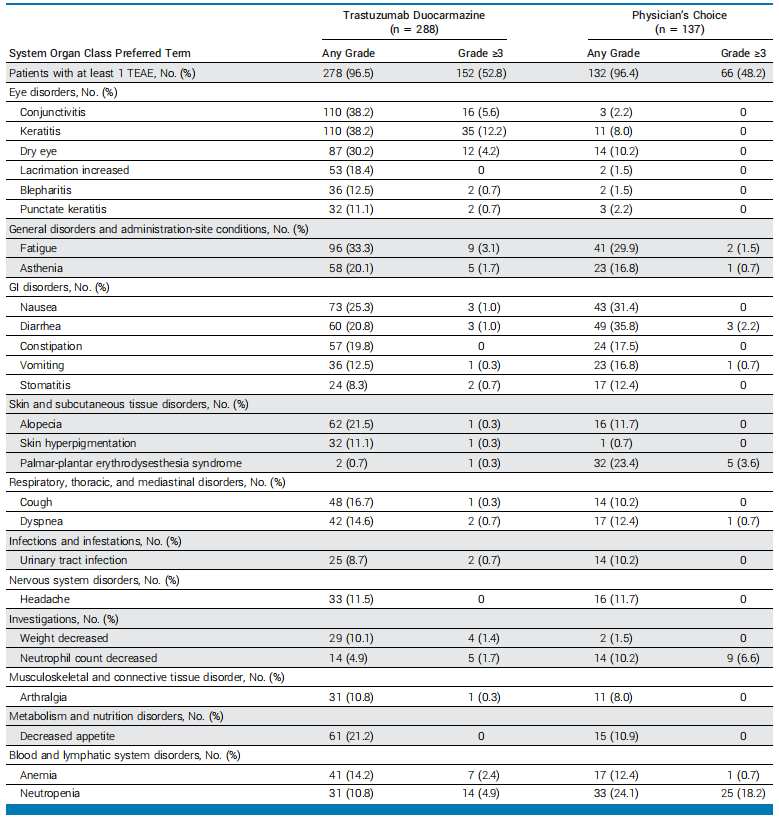
T-Duo组的不良事件发生率与PC组相似,但眼毒性发生率更高,78.1%的患者出现至少一次眼部不良事件,其中12.2%的患者出现3级以上角膜炎,T-Duo组因不良事件停药的比例更高,为35.4%,而PC组为5.8%,T-Duo组出现ILD和肺炎的比例分别为1.0%和6.6%,PC组未出现ILD和肺炎。
结论
TULIP试验是第一个评估T-Duo在HER2阳性乳腺癌中疗效和安全性的III期临床试验,研究结果显示T-Duo治疗HER2阳性乳腺癌有效,能够显著延长患者的PFS,T-Duo的耐受性受眼毒性影响,导致停药率更高,T-Duo可能是一种新的治疗HER2阳性乳腺癌的选择,尤其是在其他HER2靶向治疗药物耐药后,为HER2阳性乳腺癌的治疗提供了新的选择,T-Duo的上市有望改善HER2阳性乳腺癌患者的预后,提高患者的生活质量。总而言之,TULIP试验结果表明T-Duo是一种有效且安全的治疗HER2阳性乳腺癌的药物,为HER2阳性乳腺癌的治疗带来了新的希望。
原始出处
Turner N, Saura C, Aftimos P, van den Tweel E, Oesterholt M, Koper N, Colleoni M, Kaczmarek E, Punie K, Song X, Armstrong A, Bianchi G, Stradella A, Ladoire S, Lim JSJ, Quenel-Tueux N, Tan TJ, Escrivá-de-Romaní S, O'Shaughnessy J; TULIP Trial Investigators. Trastuzumab Duocarmazine in Pretreated Human Epidermal Growth Factor Receptor 2-Positive Advanced or Metastatic Breast Cancer: An Open-Label, Randomized, Phase III Trial (TULIP). J Clin Oncol. 2024 Oct 23:JCO2400529. doi: 10.1200/JCO.24.00529. Epub ahead of print. PMID: 39442070.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#III期临床研究# #HER2阳性乳腺癌# #T-Duo#
12