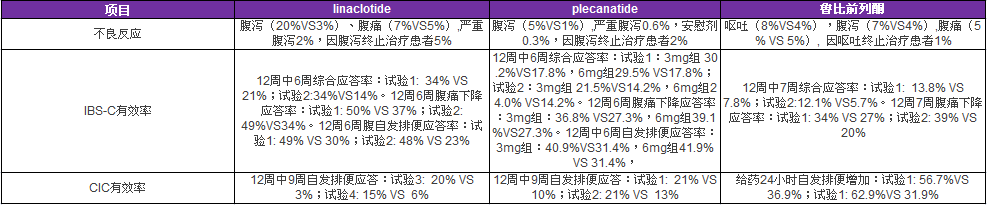
FDA扩大EUCRISA(Crisaborole)软膏适应症:至3个月大的轻中度特应性皮炎患儿
AD是一种慢性皮肤病,其特征在于皮肤发炎和皮肤屏障缺陷,在美国约有1800万人和约11%的儿童受到影响。
MedSci原创 - 特应性皮炎,儿童特应性皮炎,EUCRISA - 2020-03-25
EUCRISA软膏成为美国首个也是唯一一个用于3个月儿童患者的、无类固醇的特应性皮炎局部处方药
美国食品和药物管理局(FDA)已批准辉瑞的2%EUCRISA(crisaborole)软膏的补充新药申请(SNDA),扩展用于3个月以上的轻度至中度的特应性皮炎(AD)(又称湿疹)的儿童患者。
MedSci原创 - 儿童特应性皮炎,磷酸二酯酶抑制剂软膏,无类固醇 - 2020-03-25
详解2016年FDA批准的20款创新药(名称、活性成分、适应症……)
导读 12月14日,FDA公布了2016年批准的第20个新分子药物Eucrisa,而后朋友圈被“CDER新药办公室主任John K. Jenkins博士的FDA新药审评情况”一文刷屏了。
生物探索 - 2016年,FDA批准,20款创新药 - 2016-12-20
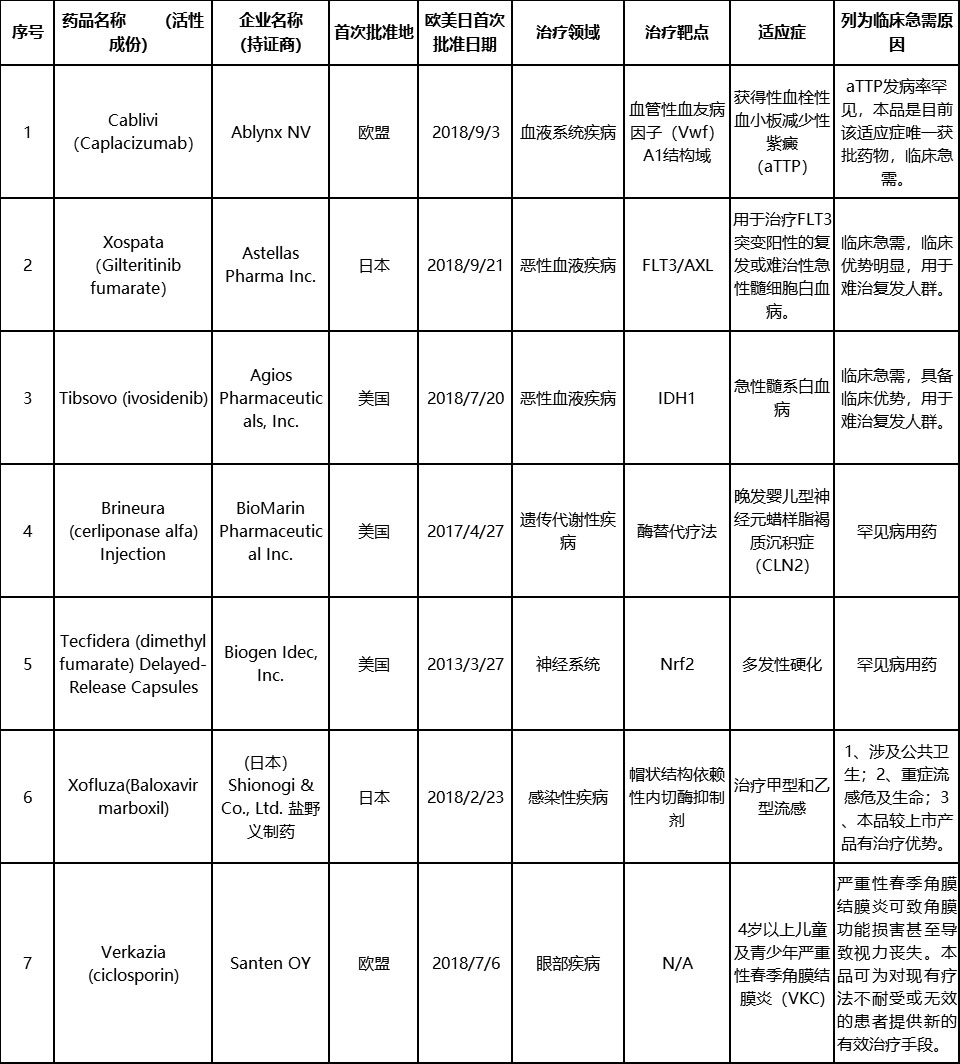
第三批临床急需境外新药名单公布
国家药品监督管理局药品审评中心(CDE)官网正式公布了第三批临床急需境外新药的名单,此次名单共纳入了7急需境外新药,针对的适应症包括获得性血栓性血小板减少性紫癜(aTTP)、急性髓系白血病、晚发婴儿型
医谷网 - 新药 - 2020-10-29
辉瑞52亿美元收购Anacor,扩充皮肤病资产
尽管制药巨头辉瑞由于美国新税法而不得不中止和艾尔建的世纪大并购,但这并没有阻挡其兼并的道路。近日,辉瑞以52亿美元收购了一家加州的生物制药公司Anacor,并因此获得一款即将完成研发的湿疹药物。 Anacor的湿疹药物名为crisaborole,是一种以PDE-4抑制剂为主要成分的凝胶,目前正处于FDA审批阶段,预计将于2017年1月份之前获批。据辉瑞估计,这有可能是一款年销售额逾20亿美元
生物谷Bioon.com - 湿疹,过敏性皮炎 - 2016-05-21
长达18页的FDA《2016年度新药审批报告》出炉咯!
导读:众所周知,2016年FDA药品审评与研究中心(CDER)共批准22个原创新药(novel drug),包括15个新分子实体和7个新生物制品。如往年一样,CDER发布了《2016年度新药审批报告》,它不仅报告批准的新药数,而且还聚焦于这些新药的医疗价值、对增强患者医疗保健的贡献以及CDER用于帮助确保这些产品安全、有效研发和审批的多种监管工具。
生物探索 - FDA,《2016年度新药审批报告》 - 2017-01-17
药品命名的一些知识点,做药的都应该知道
你是否好奇过药品是如何命名的?每个药品名称是否都有特殊的含义?是谁负责给药品命名的,是药厂、FDA、还是随手往冰箱上粘字母磁铁的孩童?
医药魔方 - 药品命名,FDA - 2017-03-07
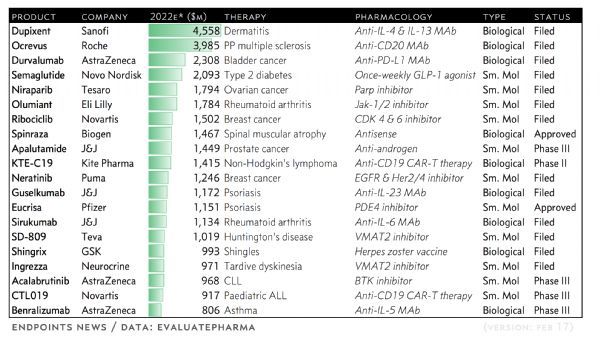
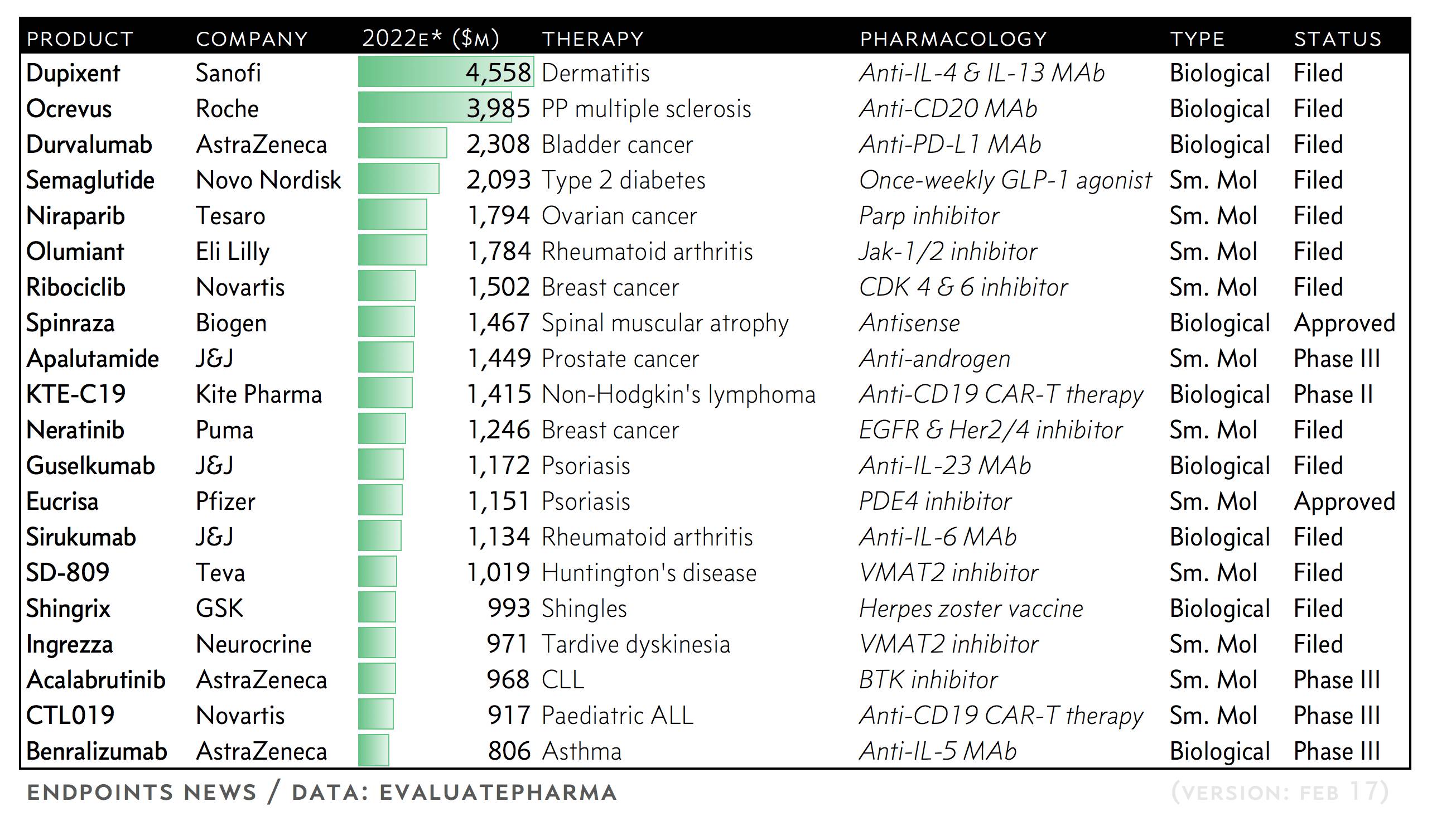
预测:2017年医药领域中15个“重磅炸弹”
每年,EP Vantage 会进行前20的小分子和生物制剂统计分析,根据预估5年内市场销售潜力进行排名。此次Evaluate’s top 20排名中有15个药物可能会成为重磅炸弹。
生物谷 - 医药领域,重磅炸弹 - 2017-02-13
2017有望上市的15种重磅药物
2017年将有众多新药被制药和生物技术公司推向市场,其中不乏年销售额可超过10亿美元的重磅药物(Blockbuster Drug)。日前,Endpoint News推出了它们预测的将于2017年上市的15种重磅药物。
药明康德 - 重磅药物,2017,上市 - 2017-02-06
2017上半年FDA批准的新药
2017上半年FDA共批准23个新药,包括16个新分子实体和7个新生物制品。这个数字已经超过2016年全年批准的新药数量总和。近20年来批准新药数量最多的年份是2015年的45个,上半年批准了14个新药。如果按此趋势持续下去,2017年批准的新药数量将创下历史新高。
新浪医药 - FDA,新药 - 2017-06-28
2017年FDA批准的41个新药
截止目前,CDER已经批准了41个新分子实体,还有2个药物的PDUFA最后期限落在12月,如12月间FDA不加速批准新药,那么2017年获批的新分子实体可能是41-43个。当然本文所涉及的新药,均为 CDER 受理的 NDA 或 BLA,并不包括CBER审评的品种,如 CAR-T 产品。相对去年的20来个,今年算是一个丰收年。已经获批的41个产品中,有31个是全球首次批准,19个产品获得了优先
科睿唯安生命科学与制药 - FDA,新药 - 2017-12-06
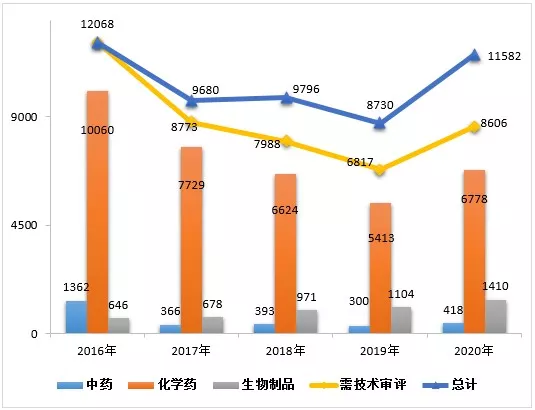
2020年度药品审评报告
2020年是极不平凡的一年,面对突如其来的新冠肺炎疫情,中国国家药品监督管理局药品审评中心(以下简称药审中心)在中国国家药品监督管理局(以下简称国家药监局)的坚强领导下,贯彻《药品管理法》《疫苗管理法
CDE - 药品审评报告 - 2021-06-23
国家药监局批准首个非激素外用PDE4抑制剂舒坦明(克立硼罗)用于特应性皮炎治疗
辉瑞(Pfizer)近日宣布,中国国家药品监督管理局(NMPA)已正式批准舒坦明(克立硼罗)2%软膏剂的进口药品注册证。舒坦明在中国被批准用于2岁及以上轻度至中度特应性皮炎(AD)患者的局部外用治疗。
生物谷 - 特应性皮炎 - 2020-08-04
为您找到相关结果约13个