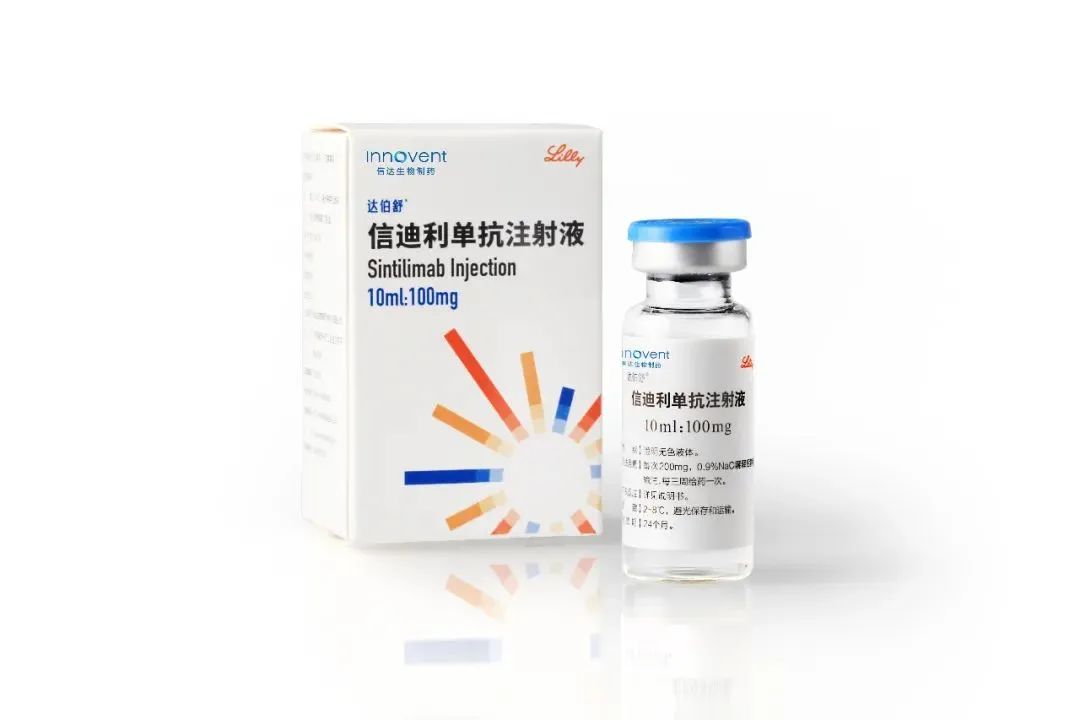
信迪利单抗申请一线治疗非鳞状非小细胞肺癌新适应症
4月24日,礼来制药和信达生物制药共同宣布:国家药品监督管理局(NMPA)已经正式受理双方共同开发的创新PD-1抑制剂达伯舒
医药魔方 - 非小细胞肺癌,信迪利单抗 - 2020-04-25
Bluebird突破性基因疗法Lenti-D申请上市!改善致死罕见病CALD患者长期生存结局
肾上腺脑白质营养不良(adrenoleukodystrophy,ALD)是一种致命性、神经退行性、X连锁隐性遗传病,发病率 0.5/10 万~1/10 万,多见于年轻男孩儿,影响全球大约21000例男
医药魔方 - 罕见病,CALD患者,Lenti-D - 2020-10-04
中国新药上市申请,阿斯利康宣布用于治疗非小细胞肺癌的沃利替尼获得优先审评
中国国家药品监督管理局(国家药监局)已正式将Savolitinib(沃利替尼)用于治疗间充质上皮转化因子(MET)14号外显子跳跃突变的非小细胞肺癌(NSCLC)的新药上市申请纳入优先审评。
MedSci - 2020-07-29
美国FDA核准武田ICLUSIG® (ponatinib)用于耐药或不耐受慢性期CML成人患者的补充新药申请
– ICLUSIG说明书更新版经证明将变革实践做法,将适应证扩大至对至少2种先前酪氨酸激酶抑制剂(TKI)耐药或不耐受的CP-CML患者 –
国际文传 - 耐药,慢性期CML - 2020-12-23
海南医学院发力“更名医科大学”:确保9月底前正式申请
地方医学院校更名“大学”消息频传。澎湃新闻记者查询发现,海南医学院官网4月2日发布了一则题为《勠力同心、锐意进取,全面推进新时代热带特色高水平医科大学建设步伐》的消息。消息透露,在今年3月29日召开的海南医学院第六届教代会暨第七次工会会员代表大会上,海南医学院党委副书记、校长杨俊作了题为《全面贯彻落实全国教育大会精神加快新时代热带特色高水平医科大学建设步伐》的行政工作报告。杨俊在报告中介绍了海南医
澎湃新闻 - 医科大学,海南,教育 - 2019-04-09
联康集团首款全生物表达新药三期临床试验申请获国家药监局受理
具备研发、生产及销售的一体化生物制药商 -- 联康生物科技集团有限公司(“联康集团”或“本集团”,股份代号:690)欣然宣布,本公司提交的重组促胰岛素分泌素注射液(“第二代Uni-E4”)三期临床试验申请于
美通社 - 联康集团,临床试验 - 2018-11-26
美FDA否决了心衰新药选择性肌球蛋白激动剂Omecamtiv mecarbil上市申请
美国FDA以8:3的投票结果拒绝批准首创新药选择性心肌肌球蛋白激动剂Omecamtiv mecarbil用于射血分数减低的心力衰竭。其主要原因是获益幅度很小、需要更多研究进一步论证。
郭艺芳心前沿 - 心衰 - 2022-12-16
拜耳向EMA及FDA提交多吉美治疗甲状腺癌的上市许可申请(MA)
昨日宣布,已向欧洲药品管理局(EMA)及FDA提交了有关口服多激酶抑制剂多吉美(Nexavar,通用名:sorafenib,索拉非尼)用于局部晚期或转移性放射性碘(RAI)难治性分化型甲状腺癌治疗的上市许可申请
生物谷 - 拜耳,FDA,多吉美,甲状腺癌 - 2013-07-03
FDA受理了用于MPS IIIA治疗的SOBI003的新药申请并授予其快速通道资格
瑞典Orphan Biovitrum AB (Sobi™) 公司近日宣布,FDA已经批准了其候选药物SOBI003的研究性新药(IND)申请,同时授予了SOBI003快速通道资格。
MedSci原创 - SOBI003,IIIA型粘多糖病,快速通道 - 2018-01-27
辉瑞/BioNTech向FDA和EMA提交二价奥密克戎特异性mRNA疫苗上市申请
继美国 mRNA 生物技术公司 Moderna上周获得了其二价疫苗的首个监管机构批准,现在 BioNTech和辉瑞表示他们已完成向美国食品和药物管理局 (FDA) 今天请求紧急使用授权,为 12 岁及
MedSci原创 - mRNA疫苗,新冠mRNA疫苗,奥密克戎 - 2022-08-23
尘螨变应原舌下片ACARIZAX® 豁免中国注册临床试验,2022年将提交上市许可申请
ACARIZAX®已在多个欧洲国家、北美、俄罗斯、东南亚、中东、澳大利亚和日本上市。
ALK - 过敏性哮喘 - 2022-03-16
强生为Darzalex申请新适应症,进军多发性骨髓瘤二线治疗
具体而言,此次sBLA申请将Darzalex联合标准护理方案[lenalidomide(来那度胺,一种免疫调节剂)+地塞米松(dexamethasone,一种激素)]或[硼替佐
不详 - 强生,Daratumumab,Darzalex,多发性骨髓瘤 - 2016-08-20
Camurus宣布FDA批准优先审核关于CAM2038丁丙诺啡注射液的新药申请
美通社 - 2017-09-22
Takeda治疗克罗恩氏病和溃疡性结肠炎新药vedolizumab申请FDA审核
Takeda制药公司研发的一种治疗炎症性肠炎药物vedolizumab报请FDA审核。这种药物主要治疗克罗恩氏病和溃疡性结肠炎。这种药物最先是由Millennium医疗公司研发的,Takeda公司花费近90亿美元将其收入旗下 详细英文报道: Takeda has taken another big step forward with one of its key late-stage dr
生物谷 - vedolizumab,Takeda - 2013-07-03
慢性疲劳综合征动物模型研究申请书(国家自然科学基金)
这是一份08年的国家自然基金标书据说初审专家给出了2A+1B的较高评价虽然在最后PK阶段被Pass了但专家还是给予了很高赞誉赶快下载看看吧记得给予评价哟摘要:作为亚健康重要组成部分的慢性疲劳综合征(CFS)将成为21世纪影响人类健康的严重问题之一,开展对CFS的系统化研究具有重要的现实意义。由于缺乏公认的CFS实验动物模型,导致CFS的基础研究以及防治研究未见突破性进展。以往的研究主要通过注射病毒
基金,自然科学基金,标书,申请书 - 2009-02-23
为您找到相关结果约500个