Science子刊:曹雪涛/姜明红/朱平合作揭示组氨酸去乙酰化酶促进IFN3介导的抗病毒免疫反应机制
2022-12-23 iNature iNature 发表于上海
这项发现揭示了一种以前未被描述的宿主防御病毒的机制,并为宿主-病毒相互作用提供了见解,为改善宿主对病原体感染的防御反应和治疗自身免疫性疾病确定了一个潜在的靶点。
表观遗传调控通过多种机制在先天免疫反应中起着至关重要的作用。乙酰化是目前研究最多的表观遗传调控机制之一,是一种重要的翻译后修饰,需要对各种生物过程进行适当的调控。
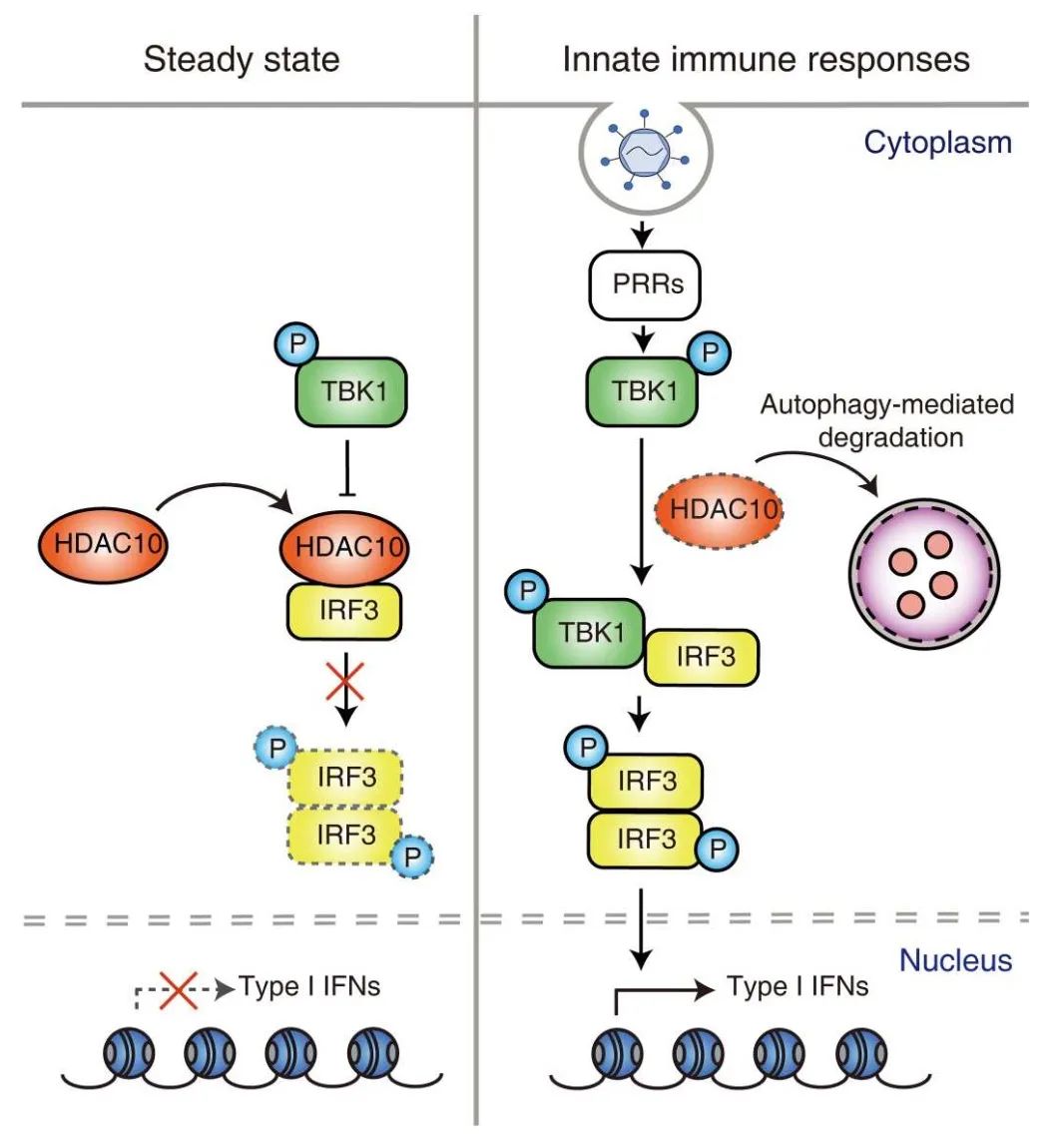
HDAC10作为组蛋白去乙酰化酶(histone deacetylases, HDACs) IIb家族成员,在各种生物过程中发挥作用,如介导同源重组,自噬介导的细胞存活和细胞周期,所有这些都依赖于它的去乙酰酶活性。HDAC10还独立于其去乙酰化酶活性调节转录和细胞增殖。此外,HDAC10作为一种有效的抑制因子,可以抑制病毒复制和HIV-1的感染性。然而,HDAC10在抗病毒先天免疫反应中的作用尚不清楚。
2022年12月20日,中国医学科学院北京协和医学院曹雪涛及姜明红与广东省人民医院朱平合作在Science Signaling 杂志在线发表题为“Degradation of HDAC10 by autophagy promotes IRF3-mediated antiviral innate immune responses”的研究论文,该研究发现HDAC10是IRF3介导的编码I型IRF基因表达的抑制剂。病毒感染后,HDAC10在宿主细胞中通过自噬降解,缓解了IRF3磷酸化的抑制,导致I型IFN的产生和抗病毒免疫反应的增强。总之,这项研究结果为IRF3信号的调控提供了见解,并提示HDAC10可能是控制感染性疾病和I型IRF相关炎症性自身免疫性疾病的靶点。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







