JITC:华中科技大学团队找到增强免疫治疗的新方法!
2022-03-14 奇点肿瘤探秘 奇点肿瘤探秘
在肺癌临床治疗中,免疫检查点疗法为患者带去了一定的希望,但是其总体响应率还是有待提高。为了提升疗效,研究人员将放疗与免疫检查点疗法进行联合。理论上来说,这两种疗法能协同增效,加强抗肿瘤免疫[1]。
在肺癌临床治疗中,免疫检查点疗法为患者带去了一定的希望,但是其总体响应率还是有待提高。为了提升疗效,研究人员将放疗与免疫检查点疗法进行联合。理论上来说,这两种疗法能协同增效,加强抗肿瘤免疫[1]。
但是在实际应用中,放疗与免疫检查点疗法的联合效果却不尽如人意。究其原因,奸诈狡猾的肿瘤细胞“野蛮生长”,而免疫细胞也总是难以浸润肿瘤中,或多处于耗竭状态,无法对肿瘤细胞进行杀伤。因此,如何增多肿瘤微环境中的免疫细胞,提高它们的杀伤力,是许多科研人员努力的方向。
研究人员把目光投向了表观遗传疗法。从驱动原发性肿瘤生长和侵袭,到调节肿瘤微环境内的免疫反应,表观遗传学机制调节着癌症生物学的多个方面。已经有研究表明,表观遗传药物可促进免疫细胞浸润或是逆转T细胞耗竭,有效改善肿瘤微环境[2-3]。表观遗传疗法与免疫检查点疗法结合,也被视为一种有潜力的治疗方案。
既然表观遗传疗法能改善肿瘤微环境,那能不能将其作为一个好助手,为免疫检查点疗法和放疗再加把劲呢?
答案是肯定的。近期,华中科技大学同济医学院附属协和医院肿瘤中心徐双兵和伍钢团队的一项研究表明,在肺癌治疗中,抑制赖氨酸特异性去甲基化酶4C(KDM4C)可促进CXCL10基因转录,增强CD8+T细胞介导的抗肿瘤免疫。抑制KDM4C与放疗和免疫检查点疗法结合,可在肺癌治疗中产生协同疗效。该研究发表在《癌症免疫治疗杂志》上[4]。

在此之前,该团队发现,KDM4C是肺癌放射敏感性的调节因子,抑制KDM4C可在体外和体内逆转肺癌对放疗的抗性[5]。既然KDM4C能调节肺癌细胞对放疗的抗性,那么其在抗肿瘤免疫反应中是否也起到了一定的作用,这些作用又是如何发生的呢?
研究人员首先从小鼠肺癌LLC模型开始探索。无论是在基因层面敲低KDM4C,还是对荷瘤小鼠给予KDM4C特异性抑制剂SD70,都能显著减小肿瘤体积,延缓肿瘤生长。
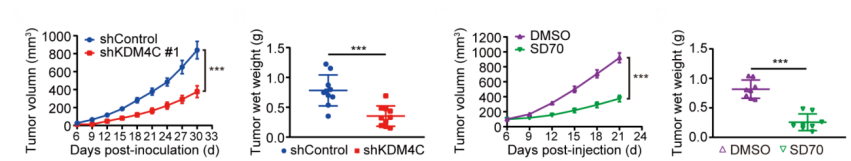
抑制KDM4C,延缓LLC肿瘤生长
众所周知,CD8+T细胞是抗肿瘤免疫中的“主力军”,肿瘤体积减小,意味着肿瘤细胞被免疫细胞所清除,所以研究人员也观察了肿瘤微环境中CD8+T细胞的变化情况。流式细胞术分析发现,抑制KDM4C使肿瘤浸润免疫细胞增多了近50%。而在体外实验中,抑制KDM4C也促进了CD8+T细胞的增殖,迁移能力也有所增强。
当然了,肿瘤浸润免疫细胞光有数量可不行,杀伤能力也得跟上。无论是体内还是体外试验,抑制KDM4C后,肿瘤浸润免疫细胞的杀伤能力和增殖能力都有所改善。不仅如此,肿瘤浸润CD8+T细胞上的耗竭分子表达降低,这就意味着,CD8+T细胞的耗竭被减缓了,有更多的具有杀伤能力的CD8+T细胞投入到抗肿瘤的战役中。
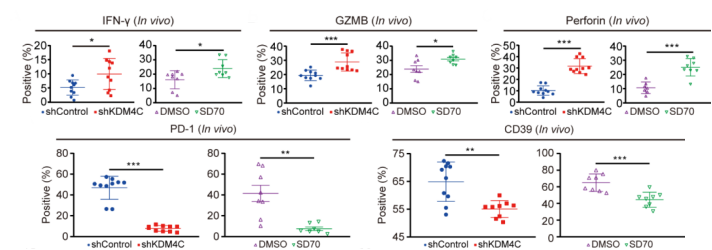
抑制KDM4C后,LLC肿瘤中免疫细胞杀伤力增强,耗竭状态的免疫细胞减少
那么,KDM4C又是通过什么分子机制控制CD8+T细胞的呢?
研究人员使用RNA测序和生物信息学分析发现,抑制肿瘤中的KDM4C后,包含CXCL10在内的六种趋化因子基因表达上调。2019年,Chen等人也发现,CXCR3/CXCL10介导的T细胞募集,促进了放化疗结合抗PD-1抗体治疗的抗肿瘤效果[6]。
基于此,研究人员推测,CXCL10可能是KDM4C的关键下游候选分子。ChIP-PCR实验结果表明,使用KDM4C抑制剂SD70处理后的肿瘤细胞,其中的H3K36me3蛋白在CXCL10基因的启动子区域富集。H3K36me3代表着组蛋白H3上第36位赖氨酸被三重甲基化,通常与基因转录的激活有关。抑制KDM4C,实现了肿瘤中的表观遗传重编程,H3K36me3不会被去甲基化为H3K36me2,H3K36me3能大量富集在CXCL10基因的启动子区域,促进了CXCL10基因表达的上调。
为了进一步确认CXCL10在抗肿瘤免疫中的作用,研究人员建立了小鼠肺癌LLC模型。给予荷瘤小鼠SD70治疗后,肿瘤生长的速度延缓了。然而,给予抗CXCL10抗体后,SD70延缓肿瘤生长的趋势则消失了。流式细胞术分析显示,给予SD70和抗CXCL10抗体后,相较于SD70单独治疗组,肿瘤浸润免疫细胞减少,免疫细胞杀伤能力下降。这就说明,抑制KDM4C,可以促进对肺癌的抗肿瘤免疫,且这种作用依赖于CXCL10实现。
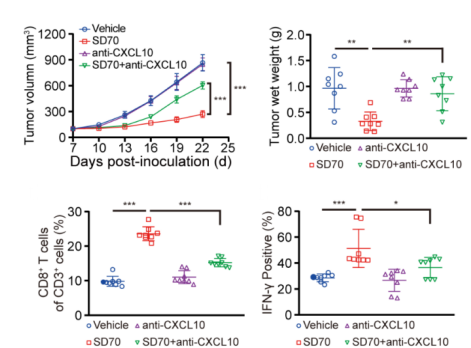
抑制KDM4C后,增强的抗肿瘤免疫由CXCL10介导
既然已经知晓了抑制KDM4C的疗效和起作用的机制,研究人员便开始思考,是否能将其与其他疗法联合使用,进一步加强抗肿瘤效果。如果抑制KDM4C可以促进CD8+T细胞的浸润,那么将KDM4C抑制剂与放疗和免疫检查点疗法相结合,是不是能产生协同治疗的效果呢?
令人满意的是,在小鼠肺癌LLC模型中,将KDM4C抑制剂与8Gy*3的放射治疗以及免疫检查点疗法抗PD-L1抗体联合使用,三员“猛将”出手,实现了对肿瘤生长的有效制,荷瘤小鼠的生存率也提高了。
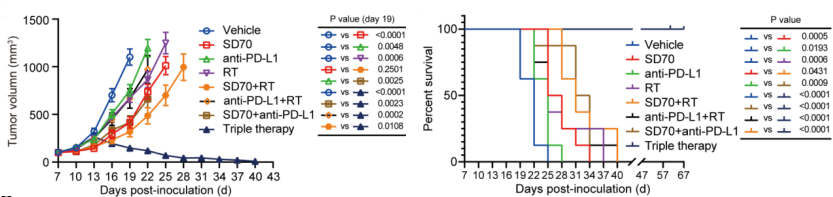
放疗,免疫检查点疗法和SD70联合,抑制了肿瘤生长,延长小鼠生存期
值得一提的是,研究人员也确认了联合疗法的安全性,HE染色结果表明,联合治疗组小鼠心脏、肝脏及脾脏等器官并未受到严重损伤。除此之外,对各组小鼠的外周血的生化分析也表明,在对照组和联合治疗组小鼠中,治疗组小鼠的肝肾功能,心血管功能及胰腺功能并无显著异常。
至此,通过这些研究,徐双兵和伍钢团队认为,抑制KDM4C,可以促进H3K36me3在CXCL10基因启动子区聚集及上调CXCL10基因表达,从而增强CD8+T细胞对肺癌肿瘤细胞的杀伤作用。使用KDM4C抑制剂能促进免疫细胞浸润,改善肿瘤微环境,给“冷”肿瘤加热,而将其与抗PD-L1抗体和放射治疗联用,能实现有效增敏,并在副作用可控的情况下,实现更佳的抗肿瘤效果。
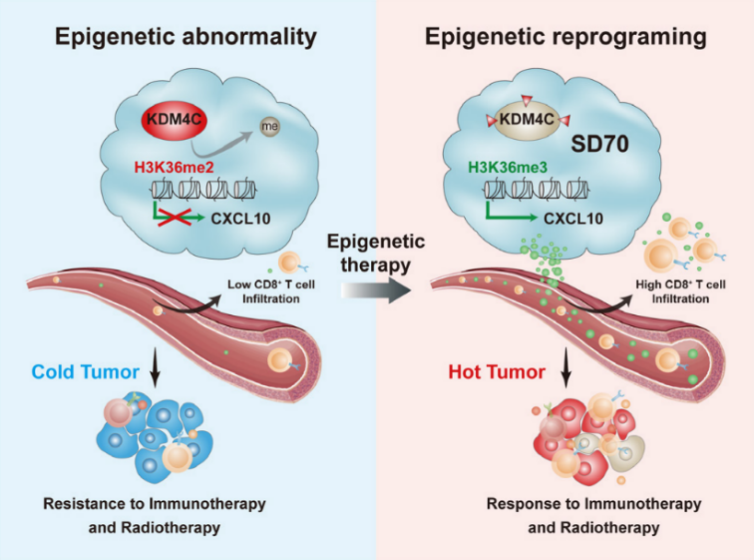
机制图
总而言之,这项研究揭示了去甲基化酶KDM4C在肺癌的抗肿瘤免疫中起到的负面作用,表明抑制参与肿瘤细胞表观修饰的酶类,或许是一种有潜力的临床辅助治疗策略。
部分表观遗传疗法能实现癌细胞表观基因组重新编程,从而破坏癌细胞的增殖或侵袭,实现对肿瘤生长的有效控制。而在过去十年中,研究人员也发现,表观遗传疗法也能调控肿瘤微环境中的免疫细胞,从而促进了免疫系统对肿瘤细胞的识别与杀伤,与其他疗法合理联用,有利于产生更强效的免疫应答[7]。
目前来看,表观遗传疗法在临床上产生了一定的效果,如果能将其更好地与放疗,免疫检查点疗法甚至是其他疗法结合,将给肺癌甚至是其他癌症患者带去更多惊喜。
参考文献:
[1]Bernstein MB, Krishnan S, Hodge JW, Chang JY. Immunotherapy and stereotactic ablative radiotherapy (ISABR): a curative approach?. Nat Rev Clin Oncol. 2016;13(8):516-524.
[2]Garcia-Martinez L, Zhang Y, Nakata Y, Chan HL, Morey L. Epigenetic mechanisms in breast cancer therapy and resistance. Nat Commun. 2021;12(1):1786.
[3] Zebley CC, Gottschalk S, Youngblood B. Rewriting History: Epigenetic Reprogramming of CD8+ T Cell Differentiation to Enhance Immunotherapy. Trends Immunol. 2020;41(8):665-675.
[4]Jie X, Chen Y, Zhao Y, et al. Targeting KDM4C enhances CD8+ T cell mediated antitumor immunity by activating chemokine CXCL10 transcription in lung cancer. J Immunother Cancer. 2022;10(2):e003716.
[5] Jie X, Fong WP, Zhou R, et al. USP9X-mediated KDM4C deubiquitination promotes lung cancer radioresistance by epigenetically inducing TGF-β2 transcription. Cell Death Differ. 2021;28(7):2095-2111.
[6]Luo R, Firat E, Gaedicke S, Guffart E, Watanabe T, Niedermann G. Cisplatin Facilitates Radiation-Induced Abscopal Effects in Conjunction with PD-1 Checkpoint Blockade Through CXCR3/CXCL10-Mediated T-cell Recruitment. Clin Cancer Res. 2019;25(23):7243-7255.
[7]Topper MJ, Vaz M, Marrone KA, Brahmer JR, Baylin SB. The emerging role of epigenetic therapeutics in immuno-oncology. Nat Rev Clin Oncol. 2020;17(2):75-90.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#新方法#
51