APC的作用及在结直肠癌中的治疗潜能
2017-06-01 佚名 肿瘤资讯
腺瘤性结肠息肉(APC)病基因是结直肠癌抑癌基因,可在胚系和体系水平出现异常调节。APC位于5q21-q22,含8535核酸,21外显子,编码310 kDa蛋白,含2843氨基酸,75%编码序列位于外显子15,是胚系和体突变最常发生部位。胚系突变致家族性腺瘤息肉病(FAP),是CRC主要易感事件,APC体突变见于>80%散发CRC,5q杂合性缺失(LOH)见于30%–40%的CRC。APC蛋白
腺瘤性结肠息肉(APC)病基因是结直肠癌抑癌基因,可在胚系和体系水平出现异常调节。APC位于5q21-q22,含8535核酸,21外显子,编码310 kDa蛋白,含2843氨基酸,75%编码序列位于外显子15,是胚系和体突变最常发生部位。胚系突变致家族性腺瘤息肉病(FAP),是CRC主要易感事件,APC体突变见于>80%散发CRC,5q杂合性缺失(LOH)见于30%–40%的CRC。
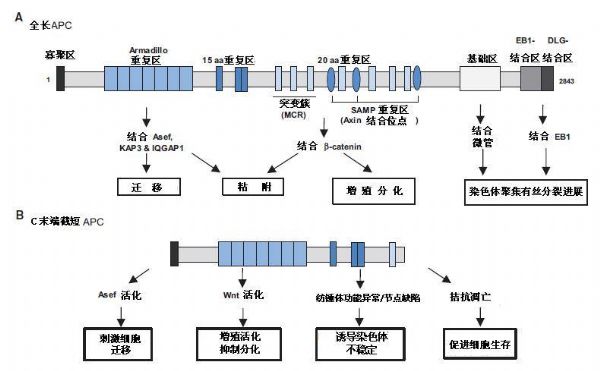
APC蛋白有多个功能区,寡聚区至少保留171个氨基酸用于结合,发挥显性抑制作用;armadillo重复区是最保守区域,与IQGAP1、PP2A、Asef和KAP3结合,刺激细胞迁移和粘附;15/20残基重复区和SAMP重复区通过降解β-catenin,负调节Wnt途径;基础区和C末端区与微管结合,直接或间接与EB1作用,稳定微管和着丝粒、促进染色体聚集。总之APC在细胞迁移、粘附、增殖、分化和染色体聚集等过程均发挥作用(图1A和1B)。
全长或截短APC主要功能和结构
APC基因改变在CRC是早期事件,但不包括MMR缺陷的MSI表型和CIMP表型。人类结肠腺瘤及其邻近粘膜的外显子测序显示APC突变存在于癌前损害,支持其在结肠腺瘤中是早期事件,靶向APC可能成为化疗预防策略。CRC共识分子亚型中的CMS2、CMS3和CMS4具有更高频APC突变。
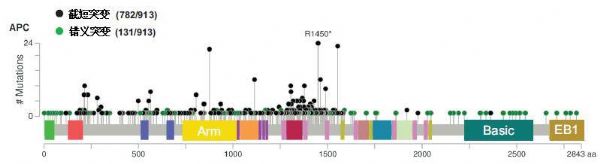
Apc突变小鼠模型研究证实,Apc突变与肠道肿瘤发生有关,虽然结直肠癌细胞的双等位基因均有突变或LOH,但APC突变通常并不导致APC蛋白完全丢失,>90%的APC突变为终止密码子提前,产生截短蛋白,多发生在突变簇区域(MCR)。CRC的APC突变谱见图2,14.3%是错义突变,85.7%为截短突变。
CRC中APC突变的分类和分布
FAP和CRC标本可检测到稳定表达的截短APC。CRC中的C末端截短蛋白缺少与微管、EB1和β-catenin的结合区域,诱导染色体不稳定、促进增殖、抑制分化(图1B)。目前认为突变致肿瘤抑制功能丢失是结肠癌开始的关键,证据显示APC截短后的主要功能有助于结肠肿瘤发生(图3)。下面将讨论APC截短后肿瘤抑制功能的丢失以及功能获得,并探讨其在结肠癌发生发展中的作用。
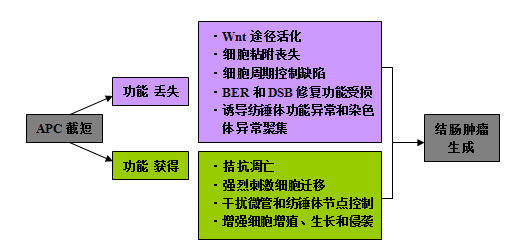
APC截短在CRC发生中的作用
CRC中APC的肿瘤抑制功能丢失
结直肠的癌前损害通过原癌基因或抑癌基因的遗传学改变而发展为肿瘤,这一过程为“腺瘤-癌”过程。APC的C末端序列丢失导致APC肿瘤抑制功能丢失是启动结肠癌的必要一步,以下介绍APC在CRC中的抑癌作用。
1.Wnt途径
APC对控制胃肠道细胞分化与增殖的Wnt途径有负调控作用,抑制β-catenin/T细胞因子(TCF)依赖的转录,机制包括为β-catenin降解提供场所,促进Axin多聚体化和稳定以增加β-catenin降解,减少核β-catenin水平,阻滞β-catenin与TCF相互作用,C末端结合蛋白介导Wnt靶基因抑制。
APC改变致β-catenin/TCF 转录活性活化,上调下游靶,如细胞周期素D1和Myc,均驱动肿瘤形成。强的选择压力利于APC保留前20个氨基酸重复序列,该序列能与β-catenin结合调节转录活性,称作“恰好”模型,APC的基因型选择与便于肿瘤生长的β-catenin水平相关。根据这一模型,若去除所有β-catenin结合位点会导致基因调节过度变化,细胞死亡风险增加,而保留部分结合位点允许转录活性部分下调,促进增殖且不诱导细胞死亡。
“三重打击”假说认为,对CRC肿瘤细胞来说恰当的Wnt水平在肿瘤进展期间是不断变化的,这种变化源于微环境的变化或获得其它遗传学改变,一些CRCs通过调节Wnt信号可以有一定反应。“恰当的核输出活性”假说认为APC截短导致核输出活性减少,削弱肿瘤抑制功能。
2.细胞粘附
有研究认为APC失活后通过降低细胞间粘附促进肿瘤发生。来自Apcmin/+小鼠肠道细胞和肿瘤细胞的胞膜E-cadherin水平以及与β-catenin的相互作用下降。截短APC CRC细胞表达全长APC时可致胞膜E-cadherin水平增高,β-catenin从核和胞浆到细胞周围,增加细胞粘附。所以APC通过控制β-catenin和E-cadherin在胞浆和胞膜分布来调节细胞粘附,突变后细胞粘附功能减弱。
3.细胞周期控制
研究显示全长APC过表达能阻滞血清诱导的G0/G1进入S期,突变APC无此抑制作用,而短暂过表达全长APC能诱导结直肠癌细胞株G1期捕获,这部分归因于APC对β-catenin/TCF介导的S期调节因素如细胞周期素D1和c-myc的调控,此外APC可能还以β-catenin非依赖性的方式影响增殖。总之突变APC的G1/S节点控制缺陷可致细胞增殖异常。
4.DNA修复
APC主要位于胞浆,可穿梭至胞核调节核功能,如DNA修复。全长APC能直接结合Pol-β、FEN1内切酶和APE1内切酶,抑制碱基切除修复(BER)蛋白在受损DNA上组装,阻滞长链BER。APC的DNA修复抑制区是Pol-β和FEN1的结合位点,位于N末端,APC突变时仍存在,因此多数截短APC仍能调节BER,只是程度不同。
据报道LoVo结肠癌细胞表达截短APC时,加速BER组装,APE1、FEN1和Polβ活性增高;再表达全长APC时减少FEN1表达,使细胞株对氟脲嘧啶敏感;APE1活性增加致BER途径不平衡,利于染色体不稳定(CIN)和癌症发展;APC还能与复制蛋白A32作用,与DNA双链断裂(DSB)修复有关。总之突变APC的BER和DSB修复功能削弱,CRC累积遗传学改变,不过CRC细胞具有APC突变时可能对损害DNA的化疗药物更易感,如奥沙利铂和氟脲嘧啶。
5.染色体不稳定(CIN)中的肿瘤抑制作用
APC能结合并稳定微管,有丝分裂细胞的着丝点处也可见APC与节点蛋白形成复合物。U2OS和HCT116细胞敲除APC后,节点蛋白与着丝点相互作用减少,有丝分裂减少;截短APC基因(Min)细胞的染色体聚集缺陷;敲除APC和/EB1可致有丝分裂纺锤体和染色体排列异常;APC截短CRC细胞可见纺锤体结构畸变和着丝点-微管附着削弱;Apc缺陷可致后期桥和染色体数目增加。总之C末端截短APC因缺少微管结合区,导致纺锤体形成异常和有丝分裂异常,有助于CIN和CRC进展。
6.APC截短的显性抑制作用
根据FAP严重性和APC截短突变的关系、突变APC蛋白与野生(WT)APC蛋白的关系,提出APC截短可能因显性抑制作用失活WT APC。外源性突变截短APC可拮抗WT APC诱导、Tcf介导的转录活性下降。另一项研究中突变APC增加β-catenin水平,促进细胞增殖和迁移。然而也有证据不支持显性抑制作用,该研究中无论小鼠是否携带编码Apc1-716(Apc△716/+)氨基酸的转基因,肿瘤数量、分布或形态学并无差别,因此认为Apc截短并无显性抑制作用。矛盾结果的原因不清楚。
APC截短:从肿瘤抑制到原癌基因?
APC缺陷结直肠肿瘤中存在双等位基因改变,但APC纯合缺失少见,研究显示APC的“二次打击”互相依赖,胚系突变发生在APC MCR时与野生型等位基因缺失相关,而MCR外突变与截短突变相关。已有报道MCR胚系突变与息肉增生严重性相关,截短APC蛋白的选择与β-catenin最适宜活性相关。证据显示APC突变后不是简单的功能丢失,还可获得新功能促进肿瘤进展。下面从细胞生存和迁移、染色体稳定性等方面详述突变APC的功能。
1.细胞生存
全长APC在结肠癌细胞中过表达时促凋亡,突变后则表现为抗凋亡,进一步研究证实APC截短蛋白不能被II组半胱天冬酶裂解,因此无法促凋亡;此外截短APC优先定位线粒体,通过Bcl-2促进细胞生存;短暂敲除SW480细胞的APC能削弱DNA复制和细胞增殖,该作用通过下调细胞周期成分实现。总之截短蛋白具有促进生存的功能,致CRC能持续存在并增殖(图4)。
CRC细胞在生长和生存上对截短APC的依赖
2.细胞迁移
APC 调节细胞迁移的机制包括控制actin骨架,调节微管网络,与Asef、GEF相互作用。APC是Asef1的配对结合体,结合后增加GEF活性,刺激Asef介导的细胞扁平化、膜皱起和MDCK细胞板状伪足形成。研究显示外源性截短APC能刺激Asef介导的MDCK细胞迁移,截短APC敲除能抑制SW480和WiDr细胞迁移。上述结果证明截短APC是Asef的活化因子,致细胞异常迁移。近期研究显示APC的N末端片段也能引起明显的细胞迁移异常。
3.染色体不稳定(CIN)中的原癌基因作用
某些截短APC对增殖、纺锤体节点控制、生存和染色体稳定性有调节作用。293细胞表达突变APC(1-1450)时主要损害纺锤体微管、诱导染色体异常聚集;只表达APC的N末端750氨基酸的细胞的着丝点-微管相互作用削弱,易发生CIN表型;另一研究中APC突变后抑制胞质分裂。这些结果显示APC突变后能诱导非整体形成,CIN是否有助于癌症发生需进一步研究。
4.APC截短显性功能的其它数据
最近有数据支持截短APC的癌基因特征。为阐明结肠肿瘤发生的分子基础,Zhang教授培养了一系列含端粒酶和CDK4的永生人类结肠上皮细胞(HCEC),这些细胞非转化、二倍体核型、具多潜能干细胞特征,能分裂形成自组织、陷窝样的类器官结构,部分细胞显示成熟上皮标志。
使用永生的HCECs,Zhang教授研究证实截短APC促使HCECs具有更多肿瘤特征,异位表达APC1309可中等程度促进增殖、生长及侵袭,而敲除>90%的WT APC无上述作用,说明APC功能缺失本身并不驱动结肠癌进展,Pineda的研究结果与之类似。此外DLD1 CRC细胞敲除截短APC后细胞增殖减慢,部分细胞死亡,下调截短APC能抑制裸鼠体内肿瘤形成。这些结果支持截短APC能促进肿瘤特征发生。
截短APC的CRC细胞在生存和维持肿瘤表型上越来越依赖截短APC(图4),特别是饥饿状态下,这在肿瘤微环境下更易发生。对突变的肿瘤抑制基因产生依赖的现象称作“癌基因粘附”。而5q LOH和APC大段缺失的CRC必需进化为不依赖APC功能才能生存。
遗传学小鼠模型
通过模型不断研究Apc在肠道稳态和肿瘤抑制方面的功能。第一个遗传性结肠癌小鼠模型是多发性肠道肿瘤(Min)模型,ApcMin/+小鼠的Apc密码子851处为截短无义突变,可研究Apc肿瘤抑制功能,但该模型的息肉和良性腺瘤多发生在小肠。
最近一系列表达截短Apc蛋白的小鼠模型诞生,多数模型腺瘤的数量及分布存在变化,突变谱与肠道表型间无明确相关性。这些模型有助于发现与结肠肿瘤发生相关途径,但也存在一些问题,特别是统计学上明显变化的表型,导致表型变化的原因包括WT Apc丢失比例和丢失机制不同,Wnt信号不同,遗传或环境因素的作用以及使用技术不同。
近期新建立的小鼠模型,Apc 15个外显子(Apc△e1-15)全部缺失,用于检测截短Apc在肿瘤形成中的作用。该模型肠道息肉分布和组织学改变与ApcMin/+相同,但高频发生于雌性小鼠,其肿瘤中Wnt活化水平较ApcMin/+低,符合“恰好”假说,即较低β-catenin水平利于肿瘤形成,但其机制不清。不过这项研究不支持截短Apc的促肿瘤功能,该结果的解释需谨慎。
所有Apc小鼠模型的共同限制在于大部分肿瘤发生在小肠,多数为腺瘤,较少发生癌症,所以遗传学工程化特异性Apc损坏的小鼠才可能是结肠癌研究更好的工具。因此需进一步研发结肠特异性Apc小鼠模型,伴Apc MCR区域截短,它能更好的反应人类CRC。
治疗潜能
APC参与许多与CRC有关的信号途径和生化过程,Wnt是受APC截短影响研究最多的途径。研究显示Apc恢复后肿瘤发生退缩,重新建立陷窝稳态,证实Wnt途径可作为CRC治疗靶点,各种小分子亦能有效抑制该途径活性,然而对正常上皮的潜在毒性以及脱靶效应限制了临床应用。APC的功能远不止于Wnt途径,但目前几乎没有药物直接靶向非Wnt途径。
使用上文提到的HCEC细胞株,小分子截短APC选择性抑制剂TASIN-1能特异性杀死癌细胞,抑制APC截短CRC生长,且对WT APC无明显影响。机制性研究显示低血清浓度下,内源性胆固醇生物合成途径和APC截短发生协同致死性相互作用,特别是TASIN-1诱导胆固醇竭耗后,SREBP2的反馈性活化削弱(图5)。TASIN-1还有细胞毒作用,但不依赖Wnt途径,对正常人类/小鼠结肠上皮无损害。
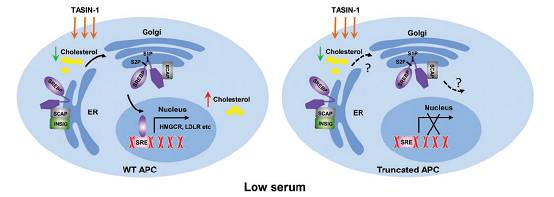
上图 WT APC细胞中,TASIN-1诱导胆固醇耗竭,使SCAP构象改变,从INSIG释放后帮助SREBPs从内质网转运至高尔基体,经S1P和S2P 裂解后转位于核,促进与胆固醇合成和摄取有关的基因活化,代偿胆固醇的减少,细胞得以生存;低血清浓度培养下,截短APC削弱了TASIN-1治疗后的正常反馈机制,细胞因胆固醇耗竭凋亡。
小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







请问这篇文章的出处是哪里
56
#APC#
43
#结直肠#
33