bioRxiv:新冠宿主的决定性因素已确定?
2022-04-13 病毒学 生命科学前沿
已通过蝙蝠和灵长类动物中 SARS-CoV-2 相互作用蛋白的不同进化轨迹确定了 COVID-19 的重要宿主决定因素
2022年4月7日,生物医学预印本bioRxiv在线发表了来自法国里昂大学、美国加利福尼亚大学洛杉矶分校、法国遗传生殖与发展研究所、德国欧洲病毒生物信息学中心和法国生物信息学研究所联合发表的研究性文章,指出已通过蝙蝠和灵长类动物中 SARS-CoV-2 相互作用蛋白的不同进化轨迹确定了 COVID-19 的重要宿主决定因素。相关文章请参考 doi: https://doi.org/10.1101/2022.04.07.48746。

先说重点
众所周知,病毒与宿主在相互作用过程中是不断进化的,在进化的过程中,许多的宿主蛋白与病毒蛋白发生了相互作用,这些相互作用蛋白被称为病毒相互作用蛋白(virus interacting proteins,VIPs)。
于是,科研人员对334种SARS-CoV-2相互作用蛋白进行了高通量进化分析,以识别SARS-CoV适应性位点并揭示现代人类、灵长类动物和蝙蝠之间的功能差异,进一步揭示在这一互作进化过程中,过去是如何塑造现代病毒库和人类的。
通过这一关系,科研人员进一步鉴定出了具有适应性进化特征的81种灵长类动物和38种蝙蝠VIPs。
紧接着,科研人员围绕着以上物种之间的共同点描绘了一个以此共同点为核心的适应性相互作用组,以此显示出不同进化轨迹中与不同宿主谱系相关的宿主特异性决定因素。
研究人员发现,灵长类动物特异性适应进入因子TMPRSS2的证据表明其在宿主体内的重要性并可依据此因子预测病毒-宿主分子交互界面。此外,与人类严重COVID-19(GWAS)相关的FYCO1位点显示出灵长类动物古代适应性的进化特征,突出了其在SARS-CoV-2复制或发病机制中的重要性以及与蝙蝠宿主差异性的关系。蝙蝠多功能蛋白RIPK1的适应性进化也预示了宿主决定性因素的相关性。
文献解析
COVID-19大流行是由SARS-CoV-2引起的,这是一种从蝙蝠病毒库溢出的新型冠状病毒(目前证据表明)。尽管进行了许多临床试验和疫苗,但疾病流行的风险仍然巨大,而且SARS-CoV-2易感性和COVID-19的严重程度在宿主层面的决定因素在很大程度上仍然未知。研究表明,在灵长类动物和蝙蝠基因组中通过比较功能遗传分析检测到的阳性选择特征可以揭示发生在病毒-宿主界面上的重要进化因素。在这里,科研人员使用 DGINN(基因创新检测),共鉴定了38种蝙蝠和81种灵长类动物蛋白质,并带有阳性选择标记。包括ACE2受体在内的17个基因在哺乳动物的两个目中都呈现出适应性标记,这表明常见的病毒-宿主相互作用和过去流行的冠状病毒在某种程度上塑造了宿主的基因组。

值得注意的是,参与炎症性RIPK1泛素化和磷酸化的残基在蝙蝠而非灵长类动物中存在迅速进化现象,这表明蝙蝠的炎症调节作用与人类是存在差异的。此外,科研人员在灵长类动物中发现了具有典型病毒宿主军备竞赛标记的残基,例如进入因子TMPRSS2或自噬适配器FYCO1,可能是药物靶标的宿主特异性体内重要界面。在灵长类动物中适应的FYCO1位点与严重的COVID-19相关,这支持了它们在发病机制和复制中的重要性这一观点。总体而言,本次研究确定了蝙蝠和灵长类动物SARS-CoV-2感染所涉及的功能性适应,这对现代病毒易感性和严重性的遗传决定因素具有重要启发意义。
蝙蝠和灵长类动物中SARS-CoV-2 VIP进化史的特征
由于病原病毒和宿主参与了进化军备竞赛,过去的流行病导致VIP基因中积累了适应性特征。当非同义密码子替换率超过同义密码子替换率时,可以通过对一组蛋白质编码直系同源物的正选择分析来识别适应性进化。科研人员对灵长类动物和蝙蝠的VIP进行了比较系统发育,发现在人类细胞中SARS-CoV-2蛋白的质谱分析中,血管紧张素转换酶2(ACE2)受体和跨膜蛋白酶丝氨酸2(TMPRSS2),两者都是病毒所必需的进入细胞。
蝙蝠和灵长类动物进化过程中具有正选择特征的SARS-CoV-2 VIP的鉴定和比较分析
科研人员在蝙蝠和灵长类动物基因的自然选择中发现了类似正向选择的趋势。其他SARS-CoV-2体外或临床研究也将这些阳性选择的基因确定为 SARS-CoV-2 VIP,从而证实了它们作为 SARS-CoV-2 调节剂或相互作用蛋白的可能。此外,阳性选择的VIP与细胞周期控制和中心体行为生物学通路密切相关,这表明细胞分裂的控制以及中心体调节的细胞极化对体内SARS冠状病毒的发展很重要。因此,这些VIP中的阳性选择标记可能代表了宿主蛋白的适应性,即这些蛋白在与哺乳动物的数百万年的共同进化中调节或与冠状病毒相互作用,代表了一组进化上常见的冠状病毒相互作用蛋白。
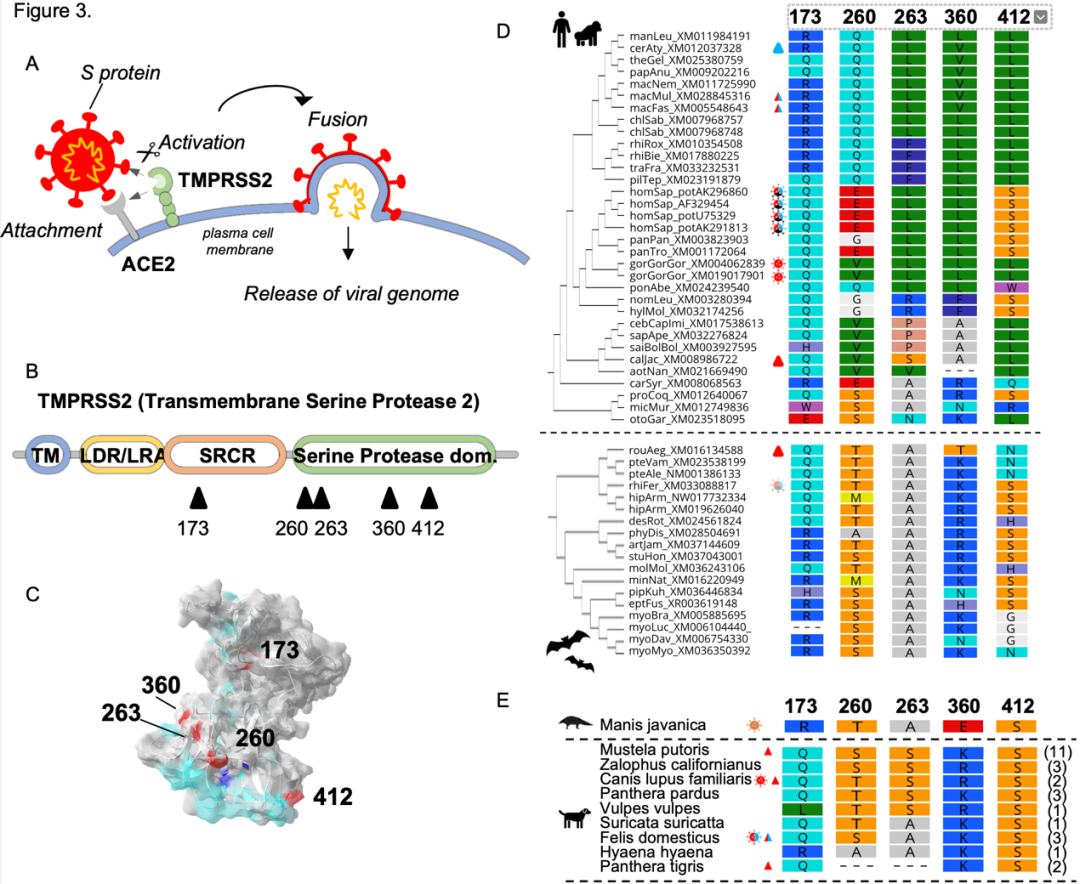
TMPRSS2中的SARS-CoV-2预测界面在灵长类动物的适应性进化下进化,但在蝙蝠中没有
在进化分析的指导下,科研人员对TMPRSS2进行诱变研究,以确定和SARS-CoV相关的决定因素,以及MPRSS2种间变异的功能含义。结果表明,TMPRSS2 中的正选择特征与灵长类动物进化过程中SARS-CoV驱动的选择压力密切相关。而以上现象未在蝙蝠中发现。
FYCO1在灵长类动物进化过程中不同时间尺度参与SARS冠状病毒发病机制或复制的证据
FYCO1参与微管运输和自噬。然而,FYCO1是人类全基因组关联研究(GWAS)中发现的极少数与严重COVID-19显着相关的基因之一。表明FYCO1在SARS冠状病毒发病机制或灵长类动物复制中的重要性。
RIPK1对人类调控至关重要的残基处一直在蝙蝠中进行适应性进化
人RIPK1是一种衔接蛋白,通过肿瘤坏死因子α受体1(TNFR1)和Toll样受体3和4 (TLR3/4)参与炎症,导致促生存、凋亡或坏死性凋亡信号。对RIPK1相互作用子的精心分析表明,它是参与关键炎症和细胞存活/死亡过程的79个细胞伙伴的中心枢纽。RIPK1与SARS-CoV-2 NSP12(RdRp)相互作用,并进一步参与多种细菌和病毒感染。
总结
分析SARS-CoV-2 VIP编码序列的研究的核心是识别多个SARS-CoV-2相互作用蛋白位点,这可能反映了病毒和抗病毒分子军备竞赛的确切位点。因此,这些位点对SARS-CoV-2宿主决定性因素至关重要。此外,VIPs代表了重要的宿主-病原体交互界面。因此,开发针对具有强烈病毒宿主军备竞赛标志的抗药物可能是一种有效的广泛抗病毒策略。
原始出处:
Marie Cariou, Léa Picard, Laurent Guéguen, et al. Distinct evolutionary trajectories of SARS-CoV-2 interacting proteins in bats and primates identify important host determinants of COVID-19. bioRxiv, 2022.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Bio#
26
#宿主#
50