TRANSPLANTATION:IL-35稳定了Treg表型以保护小鼠的心脏同种异体移植
2024-01-02 Bob Wang MedSci原创 发表于上海
心脏移植是终末期心力衰竭患者的关键选择。心脏移植后的急性排斥继续在30d内造成5%的死亡,在3y内造成11%。最普遍的排斥原因是细胞介导的排斥和抗体介导的排斥。肾毒性、机会性感染、高血糖和肿瘤是免疫抑
心脏移植是终末期心力衰竭患者的关键选择。心脏移植后的急性排斥继续在30d内造成5%的死亡,在3y内造成11%。最普遍的排斥原因是细胞介导的排斥和抗体介导的排斥。肾毒性、机会性感染、高血糖和肿瘤是免疫抑制剂的常见不利影响。因此,对异体器官移植的研究目前旨在诱导免疫耐受性、低毒性和最小的副作用。
调节性T细胞 (Treg) 需要诱导和维持移植耐受和维持移植耐受性和自我耐受性。Treg的 Foxp3+部分的治疗潜力已被澄清在几个临床模型中阐明 Treg的移植物抗宿主病 (GVHD),固体器官移植,和1型糖尿病。Foxp3+ Treg与肾异体移植和皮肤移植中更好的移植功能显著相关。T细胞免疫受体与免疫球蛋白和ITIM域 (TIGIT)-Fc治疗特异体Helos+ Foxp3+ Treg和延长角膜异体移植存活率。
此外,一些供体衍生组织 Treg可能获得移植物浸润的T细胞特征的T-浸润Treg可用于体外细胞治疗和GVHD的外周血单核细胞人化NOD-SCID IL-2受体γ-0ll小鼠模型。在第一阶段临床试验中,50%的接受肾脏移植后接受自体供体特异性Treg的接受者在1年内仍然出现急性排斥反应,免疫抑制不能完全停止。
最近,注意力集中在提供嵌合抗原受体Treg在靶向移植物上积累和扩张,在临床前模型中执行比多克隆Treg更有效的免疫抑制。因此,需要解决的一个问题是有效促进Treg的稳定性和扩展,以增加其在移植免疫学中的调节功能。
白细胞介素(IL)-35是一种免疫抑制性细胞因子,由p35(Il12a)和爱泼斯坦-巴尔病毒诱导的基因3(Ebi3)亚基组成,是IL-12异二聚体细胞因子家族(IL-12、IL-23、IL-27、IL-35和IL-39)的成员。它主要来自Treg和调节性B细胞。
最近的研究表明,IL-35在巨噬细胞、树突细胞(DCs)、内皮细胞、平滑肌细胞、单核细胞和肿瘤细胞中。然而,IL-35由于缺乏二硫键耦合而缺乏二硫键耦合,这大大减少了其分泌。Janus激酶信号转化剂和转录激活剂(STAT)通路被IL-35与二聚体受体结合激活,与其他IL-12家族成员类似,以传递信息。
IL-35诱导的IL-35产生IL-35的Treg(iTR35;CD4+Foxp3-T细胞)和调节B细胞释放IL-10或IL-35,这有助于预防自身免疫性疾病和促进肿瘤生长。在小鼠中,IL-35降低了移植胰岛细胞的功能改变Th17/Treg比率。在另一项研究中,IL-35的过度表达通过抑制CD4+效应T细胞的激活和刺激Treg在靶器官中的增殖来减少急性GVHD的免疫和临床症状。
IL-35-间充质干细胞在体内和体外持续分泌IL-35,减少Th17细胞的比例,并增加CD4+Foxp3+ T细胞在异位心脏移植模型中的比例。总之,IL-35在移植免疫中发挥着强大的免疫抑制作用。然而,还没有全面调查IL-35对实体器官同种移植中免疫细胞浸润的影响,IL-35是否直接影响移植中的Foxp3+ Treg功能尚不清楚。
2023年7月19日发表在TRANSPLANTATION等文章,演示了IL-35如何显著改善移植物存活时间。使用肿块细胞仪、流式细胞仪和免疫荧光检查了IL-35对移植物和二级淋巴器官免疫细胞浸润的影响。除了减少移植物浸润CD8+ T细胞外,IL-35还增加了Treg,并增强了免疫细胞中免疫抑制因子的表达,包括细胞毒性T淋巴细胞相关蛋白4(CTLA-4)和程序性死亡配体1(PD-L1)。

IL-35在体外对CD8+ T细胞没有直接影响,但通过保留Treg表型和增殖来抑制其激活和增殖。当接受者Treg耗尽时,IL-35对移植物延长的影响被消除了。同时,我们表明IL-35通过促进IL-35和通过gp130/STAT1途径抑制IL-17A分泌来保持Treg的稳定性和增殖。
使用肿块细胞仪、流式细胞仪和免疫荧光检查了IL-35对移植物和二级淋巴器官免疫细胞浸润的影响。此外,使用定量实时聚合酶链式反应、流式细胞仪和磷酸流分析,我们证明了IL-35通过gp130/信号传感器和转录1通路的激活剂保持Treg表型来抑制CD8+ T细胞。
研究结果显示,移植内免疫细胞的大量细胞仪分析表明,IL-35减少了CD8+ T细胞浸润,并增加了Treg中的Foxp3和IL-35表达。在体外,我们证明IL-35直接促进了Treg表型和功能稳定性及其IL-35分泌,产生了一个积极的反馈回路。
然而,Treg需要IL-35在体外对CD8+ T细胞发挥抑制作用。在消耗受体的Treg后,IL-35没有延长移植物存活率或减少CD8+ T细胞浸润。机械地,我们发现IL-35通过gp130/信号传感器和转录1信号通路的激活剂保持了Treg的稳定性。
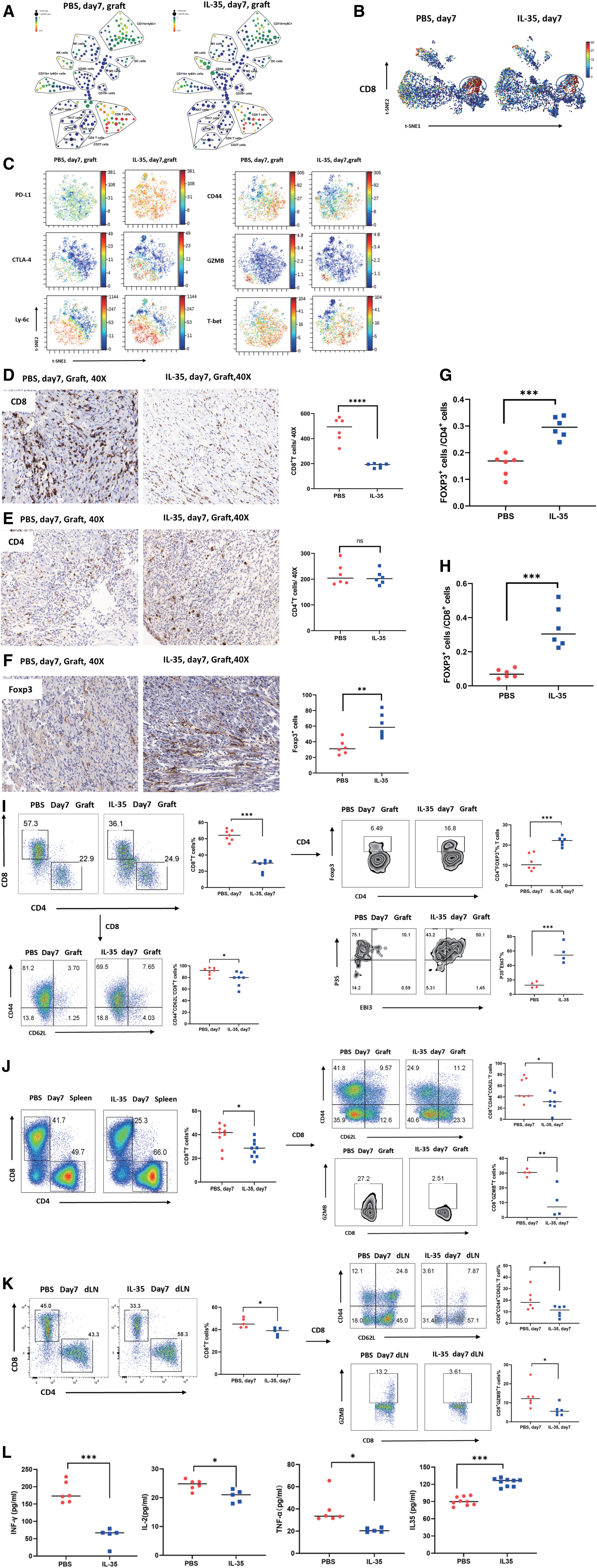
图1:IL-35通过减少CD8+ T细胞和促进移植物中的Treg来缓解移植物排斥
综上所述,IL-35可以防止小鼠对完全不匹配的心形移植的排斥。耐受性与移植物中Treg的增加和CD8+ T细胞数量的减少有关。据我们所知,移植免疫环境从未将免疫调节Treg功能描述为IL-35抑制CD8+ T细胞的桥梁。因此,我们的发现对于阐明移植中过敏细胞治疗引发的免疫调节过程以及了解IL-35如何在其他情况下调节免疫功能至关重要。
为了抑制排斥,体外通过IL-35激活的Treg的收养转移或IL-35在小鼠中的过度表达可能被证明是移植研究中Treg治疗的一种特别有效的方法。此外,IL-35表达的Treg的精确放大可能会增加人类移植耐受性。
原文出处
Huang, Ai, MD, PhD, Liu, Kewei, Yin, Ziyi, Liu, Jie, Wei, Hongyan, et al. (2024). IL-35 Stabilizes Treg Phenotype to Protect Cardiac Allografts in Mice. Transplantation, 108, 161-174. https://doi.org/10.1097/TP.0000000000004707
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#IL-35# #Treg表型# #心脏同种异体移植#
24