Nat Rev Can评论: 一个乐于助人的宿主
2013-04-01 natureasia natureasia
慢性淋巴细胞白血病(CLL)细胞的存活部分取决于来自基质细胞的从生存信号。发表在《癌细胞》杂志上的一项研究揭示了一条信号路径,能够控制这种癌细胞-基质细胞的串话。 利用共同培养的初级人体CLL细胞以及一种小鼠基质细胞系(EL08-1D2),Ingo Ringshausen和同事发现,基质细胞的存在保护CLL细胞避免凋亡。这些基质细胞与所谓的癌症相关纤维母细胞共享了遗传学与形态学特征。CLL细胞中
慢性淋巴细胞白血病(CLL)细胞的存活部分取决于来自基质细胞的从生存信号。发表在《癌细胞》杂志上的一项研究揭示了一条信号路径,能够控制这种癌细胞-基质细胞的串话。
利用共同培养的初级人体CLL细胞以及一种小鼠基质细胞系(EL08-1D2),Ingo Ringshausen和同事发现,基质细胞的存在保护CLL细胞避免凋亡。这些基质细胞与所谓的癌症相关纤维母细胞共享了遗传学与形态学特征。CLL细胞中的蛋白激酶C βII(PKCβII)已经被证明是阻止细胞凋亡所必需的,并且PKCβ抑制剂enzastaurin阻碍了EL08-1D2细胞的保护效应,意味着这种激酶在基质-CLL交互作用中的重要性。随着与CLL细胞的接触,PKCβII的表达在EL08-1D2细胞中出现了增加,而当与EL08-1D2共同培养且PKβII被小分子干扰RNA(siRNA)抑制后,或与来自Prkcb–/–(编码PKCβII)小鼠的骨髓基质细胞(BMSCs)共同培养后,CCLL细胞则不再保护避免细胞凋亡。此外,PKCβ在Prkcb–/– BMSCs中的异位表达恢复了CLL细胞的存活。总而言之,这些数据表明,PKCβII在基质细胞中是非常重要的。
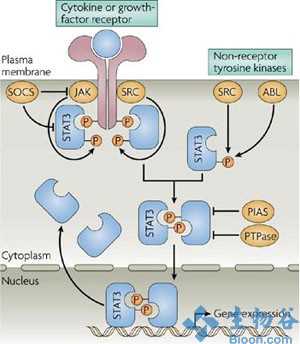
PKCβII涉及到核因子-κB (NF-κB)信号的激活;事实上,NF-κB在野生型中是被激活的,但在Prkcb–/–中并非如此,BMSC随着与CLL的共同培养,并且在与EL08-1D2细胞共同培养的CLL细胞的存活被利用一种IKKβ抑制剂( NF-κB (IκB) 激酶-β的抑制剂)的NF-κB药理学抑制所阻止。为了证明这种效应是特别针对于基质细胞的,作者使用了来自缺乏IκB联合体成员NEMO(也被称为IKKγ)的小鼠的BMSCs。有条件地敲除了Nemo的BMSCs并不能保护CLL细胞避免细胞凋亡,并且尽管被PKCβII抑制的NF-κB激活依然被诱导,但这依然意味着PKCβII在这一路径的上游起作用。在与CLL细胞共同培养后,对具有和不具有Nemo敲除的BMSCs进行的转录组分析表明了细胞因子在Nemo-裸细胞中的减少表达,并且作者指出,白细胞介素-1α(IL-1α)以及IL-15以一种NEMO依赖的方式在基质细胞中被诱导。这些细胞因子对与缺乏NEMO的BMSC共同培养的CLL细胞的外源性给予同样能够保护CLL细胞免遭细胞凋亡。
这种路径是否与活体有关呢?作者将罹患一种类CLL疾病的小鼠的恶性肿瘤细胞移植到Prkcb–/–或野生型小鼠体内,进而发现在宿主小鼠中缺乏PKCβ防止了类CLL恶性肿瘤的形成。在CLL病人体内,PKCβII在被CLL渗透的骨髓区域的内皮细胞(这些基质细胞被分析是缘于分析其他子集的技术困难)中被表达,而不是在缺乏CLL细胞的区域中。
有趣的是,作者在允许初级人体急性淋巴细胞白血病(ALL)的存活以及套细胞淋巴瘤(MCL)细胞中还观察到了一种类似的基质PKCβII–NF-κB信号需求,意味着这一路径可能对于几种血液学恶性肿瘤都是至关重要的。

doi:10.1038/nrc3470
PMC:
PMID:
Microenvironment: An accommodating host
Sarah Seton-Rogers
The survival of chronic lymphocytic leukaemia (CLL) cells partly depends on pro-survival signals that come from the stromal cells. Research published in Cancer Cell has uncovered a signalling pathway that controls this cancer cell–stromal cell crosstalk.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Nat#
26
#宿主#
34