38例川崎病合并颈深间隙受累患儿临床特征及危险因素分析
2023-09-21 协和医学杂志 协和医学杂志 发表于上海
本研究对深圳市儿童医院KD合并DNSI患儿的临床资料进行总结,分析KD患儿合并DNSI的危险因素,旨在提高临床对此类少见KD并发症的识别能力和诊疗能力。
川崎病(KD)是一种由感染诱发的全身系统性炎症疾病,多见于5岁以下儿童,主要临床表现包括发热、皮疹、球结膜充血、口唇黏膜改变、指(趾)端肿胀及颈部非脓性淋巴结肿大,15%~25%的患儿可合并冠状动脉损害(CAL),极少数患儿可出现颈深间隙受累(DNSI),此类患儿早期可仅表现为发热及颈部淋巴结肿大、淋巴结疼痛,极易被误诊为化脓性淋巴结炎或颈部脓肿并长期予以抗生素治疗,甚至部分患儿错误地接受了脓肿切开引流等有创操作。
研究KD合并DNSI患儿的临床特征有助于此类患儿的早诊早治,但我国目前尚缺乏相关病例系列研究。本研究对深圳市儿童医院KD合并DNSI患儿的临床资料进行总结,分析KD患儿合并DNSI的危险因素,旨在提高临床对此类少见KD并发症的识别能力和诊疗能力。
1 资料与方法
1.1 研究对象
本研究为回顾性分析。研究对象为2018年1月—2020年12月深圳市儿童医院风湿免疫科住院治疗的KD患儿。
纳入标准:临床诊断符合美国心脏协会制定的标准[1]:即持续发热5 d以上且具备以下5条主要临床体征中的至少4条(不满足4项者心脏超声提示CAL,亦可诊断KD):①双侧球结膜弥漫性充血;②口唇潮红、皲裂,杨梅舌;③手足指(趾)端肿胀、掌跖潮红、指(趾)端膜状脱屑;④躯干、四肢多形性充血性红斑;⑤颈淋巴结肿大(直径可≥1.5 cm),并排除其他发热出疹性疾病。
排除标准:(1)临床资料明显缺失;(2)合并咽喉部、心血管基础疾病;(3)合并链球菌、腺病毒等其他病原体感染(基于病原学诊断);(4)合并川崎病休克综合征、巨噬细胞活化综合征。
KD合并DNSI的定义:临床诊断为KD,以发热及颈部淋巴结肿大起病,经2名放射科医生评定,颈部影像学检查示患儿存在DNSI(咽后与咽旁间隙水肿,影像学表现为低密度区域边缘无强化)[2]。以是否合并DNSI,将KD患儿分为两组,其中合并DNSI者为DNSI组,未合并DNSI者为对照组(通过系统抽样法选取,DNSI组与对照组样本比例为1:7)。
本研究已通过经深圳市儿童医院伦理审查委员会审批[审批号:深儿医伦审(科研)2020035号],并豁免患儿及其监护人知情同意。
1.2 临床资料收集及相关定义
收集两组患儿的临床资料,包括主要临床特征、实验室检测、影像学特征、治疗情况及系统评分等。其中临床特征包括年龄、性别、发热时间、住院时间、颈部淋巴结肿大、颈部淋巴结疼痛等;实验室检测均于患儿入院当天且静脉注射丙种球蛋白(IVIG)治疗前(2 g/kg)完成样本采集,指标包括血常规、球蛋白、C反应蛋白(CRP)、降钙素原(PCT)、红细胞沉降率(ESR)、甘油三酯、胆红素、谷丙转氨酶(ALT)、谷草转氨酶( AST)、血清铁蛋白(FER)、血清钠离子与钾离子浓度等。
影像学特征包括颈部CT或MRI结果(评估受累部位和周围间隙情况),根据超声心动图报告评估心脏受累情况,如左心室射血分数,有无心包积液、管壁回声,管壁是否光滑等,并评估有无CAL(包括冠状动脉扩张和冠状动脉瘤)。
CAL判定标准[3]:Z值(经体表面积校正的冠状动脉内径)<2.0为冠状动脉正常;2.0~<2.5为冠状动脉扩张;2.5~<5.0为小型冠状动脉瘤;5.0~<10.0且冠状动脉内径绝对值<8.0 mm为中型冠状动脉瘤。
治疗情况包括是否使用激素,患儿对IVIG治疗的反应性,其中IVIG无反应定义为急性期大剂量IVIG治疗后36 h仍持续发热(≥38 ℃),或退热2~7 d甚至2周内再次出现发热,并符合至少一项KD典型临床表现[1]。
系统评分包括Kobayashi评分[4]和Sano评分[5],此2项评分均为患儿对IVIG治疗反应性的评价指标,其中Kobayashi评分0~3分为对IVIG治疗无反应低危患儿,≥4分为对IVIG治疗无反应高危患儿,7分以上为对IVIG治疗无反应极高危患儿;Sano评分涉及CRP(≥70 mg/L)、总胆红素(≥15.39 μmol/L)、AST(≥200 U/L)3项指标,满足其中2项即视为IVIG治疗无反应。
1.3 样本量估算
本研究以颈部淋巴结疼痛及颈部活动受限发生率为主要观察指标进行样本量估算。根据预实验结果,DNSI组和对照组淋巴结疼痛发生率分别约为60%和32%,颈部活动受限发生率分别约为70%和16%。在检验水准α为0.05,检验效能(1-β)为90%,两组样本比例为1:7的条件下,经计算DNSI组所需最低样本为37例,对照组最低为259例。
1.4 统计学处理
采用SPSS 22.0软件进行统计学分析。Kobayashi评分、Sano评分为正态分布计量资料,以均数±标准差表示,组间比较采用独立样本t 检验;年龄、发热时间、住院时间等非正态分布计量资料,以中位数(四分位数)表示,组间比较采用Mann-Whitney U 检验。
结膜充血、颈部淋巴结肿大、颈部淋巴结疼痛发生率等计数资料以频数(百分数)表示,组间比较采用χ2检验或Fisher确切概率法。采用多因素Logistic回归法分析KD合并DNSI的影响因素。双侧检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
研究期间共收治1063例KD住院患儿,其中38例(3.57%)合并DNSI,均纳入DNSI组。余1025例KD患儿中,通过系统抽样法选取341例,排除临床资料明显缺失13例,合并链球菌、腺病毒等其他病原体感染8例,合并心血管基础疾病24例(卵圆孔未闭17例、室间隔缺损2例、动脉导管未闭5例),合并川崎病休克综合征、巨噬细胞活化综合征8例,最终纳入对照组288例。
DNSI组男性26例、女性12例,发病年龄为41(19.2,59.2)个月,包括婴儿期儿童6例(15.8%)、幼儿期儿童17例(44.7%)、学龄前期儿童13例(34.2%)、学龄期儿童2例(5.2%),38例患儿均完善了颈部CT检查、18例(47.4%)患儿完善了颈部MRI检查。对照组男性171例、女性117例,发病年龄为23(13,40)个月,104例(36.1%)完善了颈部影像学检查,其中16例完善了颈部CT检查,均未完善颈部MRI检查。
2.2 DNSI组病变特征
DNSI组38例患儿中,6例(15.7%)表现为不完全KD,发热时间为4.0(3.0,5.8)d(之所以存在发热时间不足5 d的患儿,是由于其具有KD的典型临床表现,早期采取了IVIG治疗)。
口唇潮红、杨梅舌37例(97.4%),结膜充血34例(89.5%),皮疹28例(73.7%),指(趾)端红肿/脱皮24例(63.2%),肛周潮红、脱皮14例(36.8%)。38例(100%)均存在发热伴颈部淋巴结肿大(34例存在颈部多发淋巴结肿大),且颈部淋巴结肿大均在发病5 d内出现;颈部淋巴结疼痛30例(78.9%),颈部活动受限25例(65.8%),有上气道阻塞表现(打鼾、声嘶,均为轻度)7例(18.4%),咽痛2例(5.3%)。
影像学主要表现为咽后间隙和/或咽旁间隙软组织增厚、模糊、密度欠均匀等(图1),其中单纯咽后间隙受累17例(44.7%),单纯咽旁间隙受累4例(10.5%),咽后及咽旁间隙均受累17例(44.7%)。此外,存在颈椎曲度异常15例(39.4%),枢椎齿状突欠居中6例(15.7%),少数患儿(2例,5.3%)存在咽腔非对称性狭窄。

图1 1例KD合并DNSI患儿颈部CT检查表现(箭头)
A.咽旁间隙软组织增厚、密度不均;B.咽后间隙软组织增厚;C.咽旁间隙模糊、密度不均
KD:川崎病;DNSI:颈深间隙受累
2.3 DNSI组与对照组患儿临床资料比较
相较于对照组,DNSI组患儿临床资料呈现出多种显著性变化:在临床特征方面,DNSI组发病年龄更大,住院时间更长,颈部淋巴结肿大、颈部淋巴结疼痛、颈部活动受限、上气道阻塞的比例均更高(P 均<0.05);在实验室检测方面,DNSI组中性粒细胞计数及其百分比、CRP、FER、总胆汁酸、总胆红素、直接胆红素、球蛋白水平均更高,血小板、淋巴细胞计数及其百分比均更低(P 均<0.05);在CAL及治疗效果方面,DNSI组Kobayashi评分、Sano评分及激素治疗的比例均更高(P 均<0.05),见表1。
表1 两组患儿临床资料比较

2.4 KD合并DNSI的危险因素
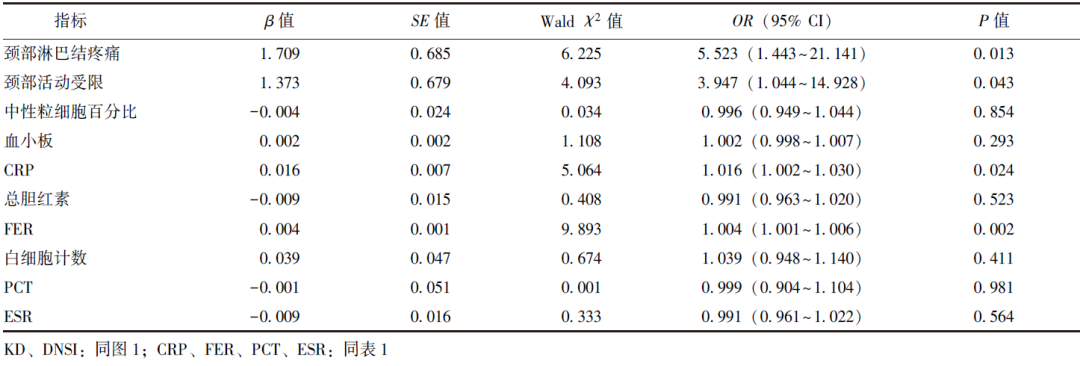
基于单因素分析结果和临床实践,选取颈部淋巴结疼痛、颈部活动受限、中性粒细胞百分比、血小板、CRP、总胆红素、FER、白细胞计数、PCT、ESR作为自变量(连续变量以实测值的形式进入模型,自变量筛选方式为向前逐步选择法),以是否合并DNSI为因变量,采用多因素Logistic回归模型进一步筛选KD合并DNSI的危险因素,结果显示颈部淋巴结疼痛,颈部活动受限,CRP及FER升高是KD患儿合并DNSI的独立危险因素,见表2。
表2 KD合并DNSI危险因素的多因素Logistic回归分析结果
3 讨论
本研究采用病例对照的研究方法,回顾性总结了KD合并DNSI患儿的临床特征,并进一步探索了KD患儿合并DNSI的危险因素,结果显示38例KD合并DNSI患儿均存在发热伴颈部淋巴结肿大且颈部淋巴结肿大均在起病5 d内出现;口唇潮红、杨梅舌37例(97.4%),结膜充血34例(89.5%),颈部淋巴结疼痛30例(78.9%),皮疹28例(73.7%),颈部活动受限25例(65.8%),指(趾)端红肿/脱皮24例(63.2%)。多因素Logistic回归分析显示,颈部淋巴结疼痛,颈部活动受限,CRP及FER升高是KD患儿合并DNSI的独立危险因素。
3.1 KD合并DNSI患儿临床特征
研究显示[6-7],KD合并DNSI患儿发病早期可仅出现颈部淋巴结肿大与发热,此类KD若不能早期识别常被误诊为咽后壁感染而导致治疗延迟,故早期有效识别KD合并DNSI患儿具有重要意义。总结KD合并DNSI患儿的临床特征,有助于提高临床医师对该病的识别能力,助力精准诊疗的实现。
既往美国一项基于不同种族人群诊疗数据回顾KD合并DNSI患儿临床特征的研究显示[8],KD合并DNSI的比例为0.6%,常见于>4岁非白种人、非西班牙裔儿童,易被误诊为脓肿而行手术引流,以致住院时间及住院费用增加。目前国内KD合并DNSI患儿相关研究多为个案报道[9-10],尚缺乏此类存在DNSI受累KD患儿临床特征的系统总结。
本研究基于深圳市儿童医院诊疗数据,对KD合并DNSI患儿的临床特征进行了单中心总结,结果显示1063例住院的KD患儿中,合并DNSI的比例为3.57%(38例),此数据较文献[8]报道结果显著升高,可能原因:(1)KD患儿合并DNSI的比例具有种族差异性,其发病率在东亚人群中较西方人群升高[1];(2)本研究为单中心数据且DNSI样本量小,易存在偏倚。
38例KD合并DNSI患儿中,中位年龄为41个月,男女比例为2.17:1,均存在发热伴颈部淋巴结肿大且颈部淋巴结肿大均在起病5 d内出现,与既往报道相符[11]。
本研究结果显示,78.9%的KD合并DNSI患儿存在颈部淋巴结疼痛,65.8%的患儿存在颈部活动受限,此数据较单纯KD患儿明显升高(19.8%、11.1%),提示KD合并DNSI的患儿颈部淋巴结疼痛及颈部活动受限的表现更为突出。影像学可见颈部淋巴结多发肿大、咽后或咽旁间隙密度不均、模糊等表现,亦证实了DNSI的存在。实验室检测显示,KD合并DNSI患儿白细胞计数、中性粒细胞计数及其百分比、CRP、PCT等炎症标志物水平更高,表明其存在更强的炎症反应,且存在肝胆损害的表现(胆汁酸、胆红素水平更高),提示其病变程度可能更严重(高风险KD)。
此外,既往日本一项KD合并咽后间隙受累(炎症浸润所致)的研究显示[11],KD患儿存在咽后间隙受累的比例为3.6%,其影像学多表现为病灶部位低密度改变,而常规咽后壁脓肿或感染患儿多表现为以低密度为核心的环形强化[12],提示早期发热伴颈部淋巴肿大且对抗生素治疗无效,尤其合并颈部活动受限的KD患儿,需警惕DNSI的存在,可行颈部影像学检查以辅助临床鉴别诊断。
KD可损伤血管内皮并导致冠状动脉受累,其中多数冠状动脉损伤可逐渐恢复,仅少数发展为CAL,其中冠状动脉瘤是KD最严重的并发症之一,其可导致冠状动脉狭窄,诱发心肌梗死。目前国内外在KD合并DNSI是否增加CAL发生风险方面尚未达成一致结论,有研究认为合并DNSI后KD患儿发生CAL的风险增加[13],但亦有文献表明DNSI对CAL无明显影响[7-8]。
本研究单纯KD患儿的CAL(冠状动脉扩张,未发现冠状动脉瘤患儿)发生率为17%,而KD合并DNSI患儿中该数据为21.1%,二者差异无统计学意义,暂未发现DNSI可显著增加KD患儿发生CAL的风险。
不同研究之间结果存在差异,考虑如下原因:(1)本研究KD合并DNSI患儿病例数较少且缺乏长期随访数据;(2)KD合并DNSI患儿使用激素治疗的比例更高,对于改善预后、减轻冠状动脉损伤具有积极作用。需强调的是,虽然本研究未发现DNSI对KD患儿CAL发生风险有明显影响,但此类患儿发生高风险KD的风险增加。
Kobayashi评分、Sano评分均是评估IVIG治疗效果的评价指标,其评分越高表示对IVIG治疗无反应的风险越高,在亚洲人群中已证实该评分对IVIG无反应型KD的预测具有较高的灵敏度和特异度[6]。虽然本研究两组IVIG治疗无反应的患儿比例基本相当,但KD合并DNSI患儿的Kobayashi评分、Sano评分均更高,提示其发生IVIG抵抗的风险更高,考虑与更强的炎症反应相关。
3.2 KD合并DNSI的危险因素
探究KD合并DNSI的危险因素,可提高临床对DNSI高风险KD患儿的识别能力,进而采取针对性措施,不仅有助于DNSI的预防,也可降低KD疾病负担,但目前尚未见此类报道。
本研究基于单因素分析结果,采用多因素Logistic回归法进一步筛选KD患儿发生DNSI的危险因素,结果显示颈部淋巴结疼痛、颈部活动受限、CRP及FER升高是KD患儿合并DNSI的独立危险因素。
分析可能的机制:(1)KD主要累及毛细血管、小动脉及小静脉,KD合并DNSI患儿CRP及FER升高提示更高的炎症反应,表明此类患儿微血管炎更严重,从而引起血管白蛋白渗漏和水肿[14],导致颈深间隙无菌性炎症。(2)文献报道,病原相关分子模式(PAMP)参与KD急性期发病过程,PAMP触发内皮细胞激活和炎症细胞聚集,导致系统性血管炎,而持续的炎症可诱导CD4+ T细胞活化,促进淋巴结反应性增生[15],结合颈深间隙组织疏松、血管丰富的特点,易引起颈部疼痛、活动受限,因此,出现颈部淋巴结疼痛、颈部活动受限表现可能提示颈部炎症更剧烈,为DNSI的诱发因素。
本文是我国KD合并DNSI病例系列研究的首次报道,为此类患儿的临床诊疗提供了参考依据。本研究局限性:(1)KD合并DNSI患儿病例数仍受限,作为对照的单纯KD患儿并非均完善了颈部影像学,部分指标观察结果可能存在一定偏倚。(2)部分患儿的随访时间较短,DNSI对CAL发生风险的影响需进一步研究证实。
综上,多数KD合并DNSI患儿出现颈部淋巴结肿大、颈部淋巴结疼痛、颈部活动受限等临床症状,血液学提示存在高强度炎症反应。颈部淋巴结疼痛、颈部活动受限、CRP及FER升高是KD患儿合并DNSI的危险因素。对于疑诊KD合并DNSI的患儿,可早期完善颈部影像学检查,以避免误诊。
原始出处:
朱晓娜, 程雪莹, 翁若航, 夏宇, 罗颖, 何庭艳, 杨军. 38例川崎病合并颈深间隙受累患儿临床特征及危险因素分析[J]. 协和医学杂志, 2023, 14(2): 285-291. doi: 10.12290/xhyxzz.2022-0510
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言