华中科技大学顾劲扬团队J Clin Invest:ZBP1介导的凋亡与炎症加重脂肪变性供肝缺血再灌注损伤
2024-05-20 BioMed科技 BioMed科技 发表于上海
该研究建立了全新的ZBP1-RIPK1互作理论模型,并揭示了其在脂肪变性供肝IRI中的关键作用,为提升脂肪变性供肝移植疗效奠定了重要基础。
缺血再灌注损伤(IRI)是肝移植不可避免的病理过程。随着生活方式的变迁,国人脂肪肝患病率已跃升至30%,脂肪变性供肝在肝移植中的使用频率亦随之日渐升高,但其对IRI的易感性显著升高,IRI继发的原发性移植物无功能等多种危重并发症对肝移植受体生命构成严重威胁,相关分子机制尚不清楚。

2024年5月14日,华中科技大学同济医学院附属协和医院肝脏移植中心顾劲扬教授团队在J Clin Invest在线发表题为“ZBP1-mediated apoptosis and inflammation exacerbate steatotic liver ischemia-reperfusion injury”的研究,该研究采用多种基因敲除小鼠模型,揭示了Z-DNA结合蛋白1(ZBP1)表达及活化是脂肪变性供肝IRI中细胞凋亡及炎症反应过度激活的关键机制。该研究发现敲除caspase-8仅抑制脂肪变性供肝IRI中的凋亡但不影响炎症,而阻断RIPK1激酶可通过同时缓解凋亡和炎症显著减轻IRI。此外,在脂肪变性供肝IRI中,RIPK1激活是由ZBP1而非经典的TNFα通路诱导的。在机制上,过量棕榈酸激活的JNK通路在脂肪变性供肝中诱导ZBP1表达水平升高。在IRI中,过量活性氧(ROS)通过Z型核酸(Z-NA)非依赖性机制促进ZBP1聚集,进而ZBP1寡聚体通过RHIM结构域招募并激活RIPK1,最终通过凋亡及炎症加重肝损伤。该研究建立了全新的ZBP1-RIPK1互作理论模型,并揭示了其在脂肪变性供肝IRI中的关键作用,为提升脂肪变性供肝移植疗效奠定了重要基础。
程序性细胞死亡由特定的分子机制介导,在健康和疾病中起着重要作用。半胱氨酸蛋白酶caspase家族是程序性细胞死亡的关键调节因子。凋亡是首个确定的细胞死亡的调控形式,由caspase-3/7执行,它们被上游的caspase-8或caspase-9激活从而响应细胞外细胞死亡诱导细胞因子或细胞内应激信号。当caspase-8被抑制时,同样的细胞因子也会引起由RIPK1、RIPK3和MLKL介导的坏死性凋亡。炎性caspase,包括caspase-1/4/5/11,通过剪切GSDMD诱导焦亡。此外,膜磷脂的多不饱和脂肪酸过氧化会引发caspase非依赖的坏死,称为铁死亡。然而,肝IRI中肝细胞死亡的机制尚未完全阐明。
ZBP1是近年新发现的固有免疫传感器,在监测到Z-NA后引发细胞死亡。ZBP1激活的细胞死亡首先在甲型流感病毒感染中被描述,随后被扩展到其他病原体的感染。此外,无菌环境中RNA编辑酶ADAR1的突变也会导致ZBP1依赖性免疫病理。因此,除了外源性病原体相关的Z-NA外,ZBP1还可以被特异性内源性Z-NA激活,从而可能导致机体稳态失衡。然而,尚不清楚ZBP1是否可被Z-NA以外的信号激活。
为了探究脂肪变性供肝IRI机制,该研究首先检测肝移植临床样本、小鼠缺血再灌注模型、大鼠肝移植模型、原代肝细胞缺氧复氧模型中的IRI。H&E染色及TUNEL染色表明脂肪变性供肝IRI显著加重,MPO染色及血清促炎细胞因子ELISA表明脂肪变性供肝IRI中炎症活化水平升高。采用免疫印迹进一步发现,以caspase-8及caspase-3剪切为标志的外源性凋亡在IRI中激活,且在脂肪变性供肝中活化水平进一步升高,而IRI后的肝细胞中并未检测到明确的坏死性凋亡及焦亡。除此之外,4-HNE染色揭示的脂质过氧化在脂肪变性供肝中未进一步升高。因此,脂肪变性供肝IRI易感性可能是由凋亡及炎症介导的。
由于caspase-8剪切增多,采用Casp8肝细胞特异性敲除小鼠进一步探究其功能。Casp8全敲小鼠由于坏死性凋亡失去抑制而胚胎致死,但肝敲小鼠无明显异常,这与肝细胞RIPK3表观遗传沉默而无法发生坏死性凋亡一致。敲除Casp8后,IRI诱发的细胞凋亡显著减少,但整体损伤程度仅微弱缓解,炎症亦无明显改变。使用AAV8敲低大鼠肝脏Casp8后进行肝移植模型,结果与小鼠IRI模型一致,提示caspase-8介导的细胞凋亡仅部分参与脂肪变性供肝IRI。
Caspase-8介导的凋亡分为RIPK1激酶依赖及非依赖两种,由RIPK1是否磷酸化活化决定。实验结果显示RIPK1在IRI中发生活化,并且在脂肪变性供肝中活化程度进一步升高。在RIPK1激酶失活D138N敲入小鼠或用RIPK1激酶抑制剂Nec-1s灌注供肝的肝移植大鼠中,IRI相关肝细胞凋亡及炎症均显著降低,肝脏整体损伤亦得到明显保护。因此,RIPK1通过促进凋亡及炎症加剧IRI。
RIPK1通常在TNFα通路中被激活,而TNFα在IRI中被显著诱导。然而,在Tnf敲除小鼠或敲低肝脏TNFR1的大鼠中,IRI引发的RIPK1活化并未被明显抑制,细胞凋亡、炎症反应及损伤程度亦无明显减轻,提示在脂肪变性供肝IRI中RIPK1激活是独立于TNFα而发生的。
RIPK1与RIPK3、TRIF、ZBP1蛋白均含RHIM结构域,后者介导的上述蛋白间相互作用可能提供支架促进RIPK1活化。为此,分别采用Ripk3、Trif、Zbp1敲除小鼠造模评估损伤。在高脂喂养的脂肪肝小鼠中,敲除Zbp1显著抑制RIPK1活化,并减轻细胞凋亡及炎症从而降低损伤,而在正常小鼠中无明显效果,敲除Ripk3或Trif在各组中均无明显效果。转录组测序提示多种炎症信号通路在Zbp1敲除组显著下调。AAV8敲低大鼠供肝ZBP1后,脂肪变性供肝而非正常供肝亦得到明显保护。此外,ZBP1仅在IRI脂肪变性供肝中与RIPK1特异性结合。因此,ZBP1特异性介导脂肪变性供肝的IRI(图1)。
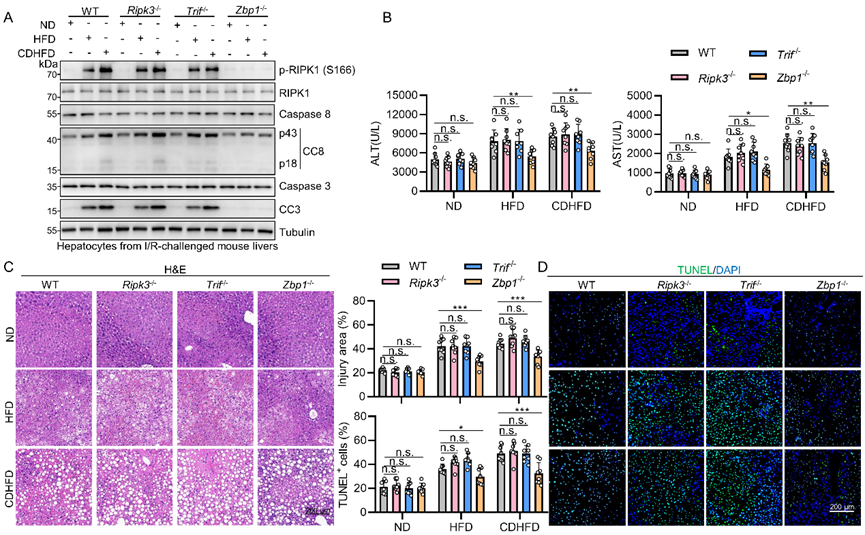
图1. ZBP1特异性介导脂肪变性供肝IRI
在上述结果中注意到肝脏ZBP1的表达水平在脂肪变性后显著升高,这可能是ZBP1仅在脂肪变性供肝中产生调控作用的原因。在ZBP1肝移植临床样本中,供肝ZBP1表达水平与移植后损伤呈正相关。正常饮食喂养的小鼠肝脏ZBP1表达水平极低,因此,使用AAV8特异性在其肝细胞中过表达ZBP1,随后对其进行IRI模型构建。过表达ZBP1显著加重肝脏RIPK1活化、凋亡与炎症及损伤,且被Nec-1s阻断,表明ZBP1通过激活RIPK1加重IRI。
在脂肪变性供肝中,ZBP1的mRNA水平亦显著上调,提示ZBP1可能在脂肪变性背景下发生转录活性升高。JASPAR网站预测ZBP1启动子含c-Jun结合位点,棕榈酸刺激原代肝细胞后,ZBP1的mRNA及蛋白水平均显著上升,且被JNK通路抑制剂SP600125或敲低c-Jun阻断。因此,在脂肪变性供肝中,棕榈酸活化的JNK通路促进ZBP1转录表达(图2)。
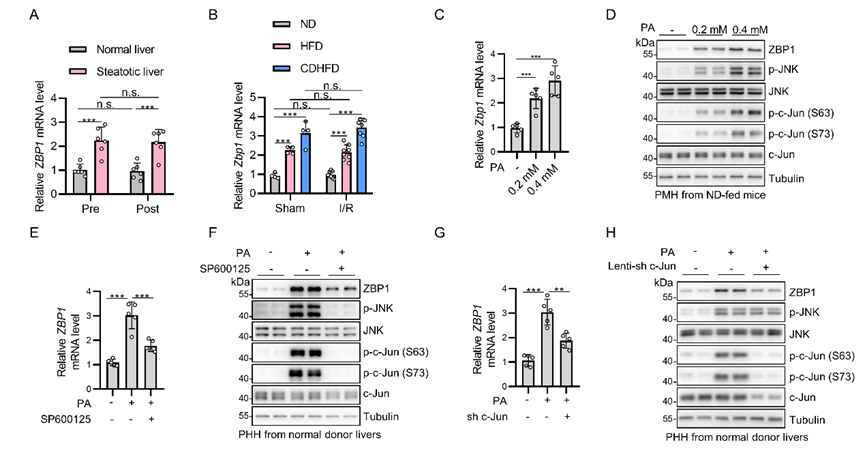
图2. 在脂肪变性供肝中棕榈酸活化的JNK通路促进ZBP1转录表达
正常饮食喂养小鼠肝脏过表达ZBP1而未进行IRI操作时,肝脏并未有明显异常,提示IRI通过某种机制诱导了ZBP1的激活。ZBP1含有两个感知Z-NA的Zα结构域,将删除Zα结构域的ZBP1以AAV8的方式在正常喂养小鼠肝脏过表达后IRI依然加重,表明Z-NA感知不是ZBP1活化的关键机制。与此相反,过表达删除RHIM结构域的ZBP1并未加重IRI,提示RHIM结构域对ZBP1发挥功能不可或缺。
通过聚集形成高阶超分子复合物通常是细胞死亡诱导蛋白激活所必需的,包括ZBP1。在IRI后的脂肪变性供肝中免疫荧光及非还原免疫印迹检测到了ZBP1聚集。ROS可能修饰半胱氨酸从而促进蛋白质形成二硫键,且过量ROS是IRI的关键驱动因素,故推测ROS可能直接诱导ZBP1聚集及激活。H2O2或IRI均导致ZBP1聚集,且被ROS清除剂NAC阻断。因此,在IRI中,ROS直接促进ZBP1聚集从而将其激活(图3)。
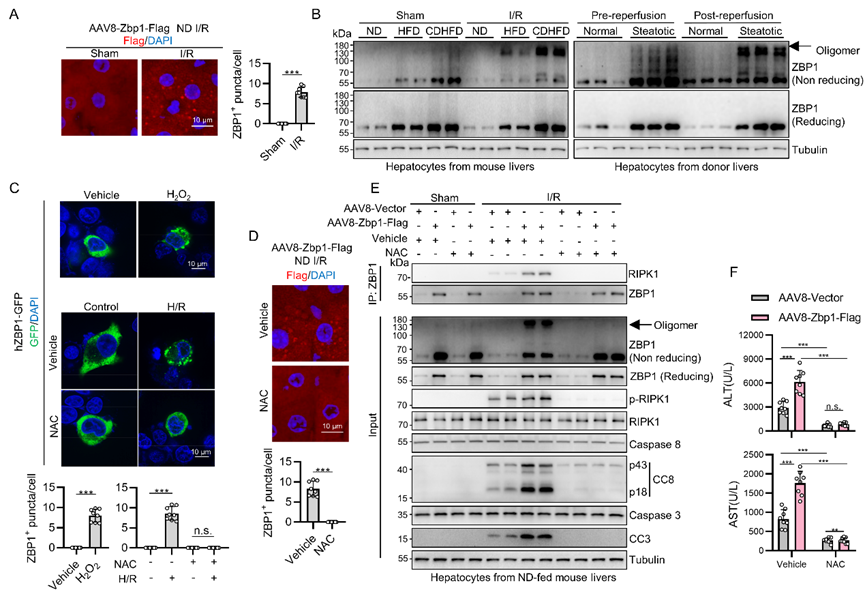
图3. 在IRI中ROS直接促进ZBP1聚集从而将其激活
综上所述,在脂肪变性供肝中,过量棕榈酸激活的JNK通路上调ZBP1表达水平。在IRI中,过量ROS促进ZBP1聚集及活化,进而ZBP1寡聚体通过RHIM结构域招募并激活RIPK1,最终通过凋亡及炎症加重肝损伤(图4)。
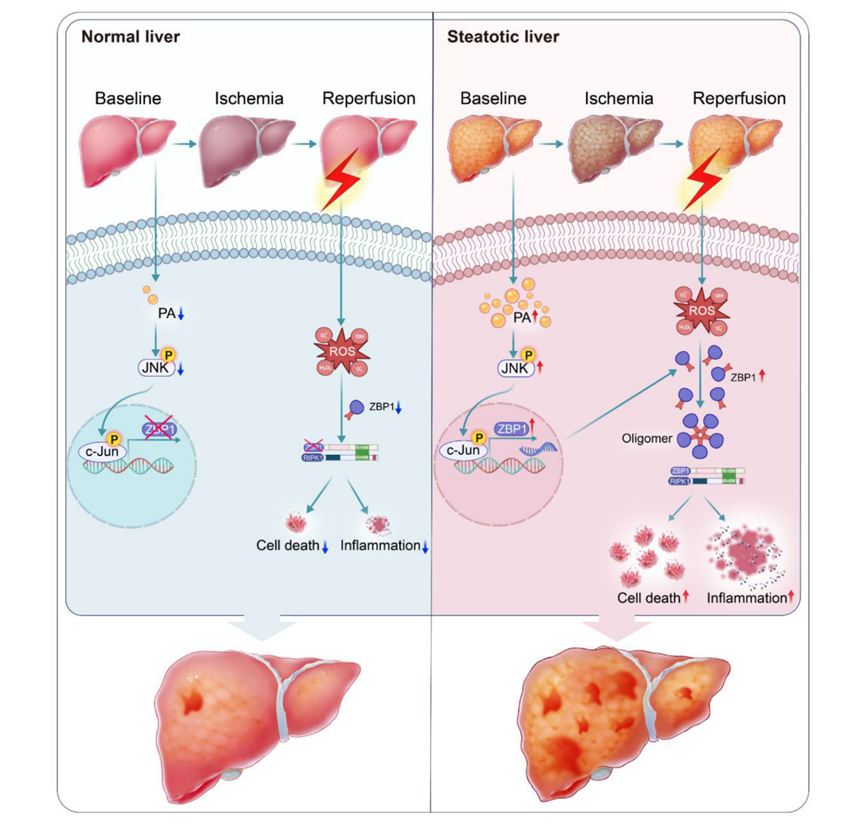
图4. 该研究机制图
华中科技大学同济医学院附属协和医院肝脏移植中心顾劲扬教授为该论文唯一通讯作者,刘冉、曹欢、张树华、蔡瑁、邹天浩为共同第一作者。
顾劲扬教授课题组长期致力于脂肪变性供肝缺血再灌注损伤的机制及其转化研究,近年来获得包括国家自然科学基金重点及面上项目、省自然科学基金创新群体重点项目在内的20余项课题资助,并在J Clin Invest、Nat Commun (2篇)、Gastroenterology、Hepatology (4篇)、Cell Rep、J Hematol Oncol、Cell Mol Immunol、Adv Sci、Genome Med等国际Top期刊发表SCI论文60篇,其中IF>10分论著14篇。课题组学生主持多项校级基金,并获得三好学生、校级优秀毕业生等多项荣誉。
原文链接:
https://www.jci.org/articles/view/180451
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言














#肝移植# #脂肪变性# #Zbp1#
7